
题目列表(包括答案和解析)
6. 已知NH3和HCl都是能用来作喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl气体未满,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系
已知NH3和HCl都是能用来作喷泉实验的气体。若在同温同压下用等体积烧瓶一个收集满NH3,另一个收集HCl气体未满,如图所示,喷泉实验停止后,两个烧瓶内溶液的关系
是(不考虑溶质的扩散及静止时液面高度的影响) ( )
A.溶质的物质的量浓度相同、溶质的质量分数不同
B.溶质的质量分数相同,溶质的物质的量浓度不同
C.溶质的物质的量浓度和溶质的质量分数都不同
D.溶质的物质的量浓度和溶质的质量分数都相同
5.下列各组离子在指定溶液中能大量共存的是 ( )
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、[Al(OH)4]-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
A.①② B. ②④ C.③⑥ D.⑤⑥
4.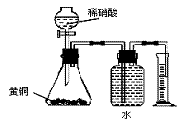 下列实验操作正确的是
( )
下列实验操作正确的是
( )
A.氢氧化钠固体放在滤纸上称量
B.用如右图所示的装置可以测定黄铜(Cu、Zn合金)中 Zn的含量
C.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质可以是H2O、Ba(OH)2、Na2CO3、HCl
D.配制0.184 mol/L H2SO4时,向1000 mL容量瓶中注入10 mL 18.4 mol/L H2SO4然后边加水边振荡,最后定容
3、下列物质露置于空气中易变质的是 ( )
①氯水 ②“84”消毒液 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠 ⑦过氧化钠
A、除⑤外 B、除②③外 C、除②③⑥外 D、全部变质
2、下列有关胶体说法正确的是 ( )
A.通过电泳实验证明胶体带电.
B.溶液与胶体:本质不同的原因不是能否发生丁达尔效应
C.渗析实验说明胶体粒子能透过半透膜
D.向煮沸的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体
1.下列说法不正确的是 ( )
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假说等方法。
B.,电解质在融化状态下不一定能够导电
C.硅是将太阳能转化为电能的常用材料
D.先开发资源再治理环境的发展理念符合可持续发展的基本国策
28.(16分)下图表示各物质(均为前20号元素组成)之间的转化关系,其中A、B、C、G为单质。②为工业生产中常见反应,E是一种具有漂白作用的盐,Y易潮解,M是一种两性氧化物,L是一种白色沉淀,F是常见无色液体。
试回答下列有关问题:
(1)M的化学式 ,Y在实验室中的用途 (列举一例)。
(2)X的熔点为801℃,实际工业冶炼中常常加入一定量的Y共熔,猜想工业上这样做的目的: 。工业生产中,还常常利用电解X和F的混合物制取 。
(3)A和氨气反应有白烟和新的单质生成,写出化学反应方程式 。其中还原剂与还原产物的物质的量之比为 。
(4)反应④的离子反应方程式是 。
27.(12分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
 (1)t1时,开始有C1O3-生成的原因是
(1)t1时,开始有C1O3-生成的原因是
__________________________________________________
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:
。
(3)该石灰乳中含有Ca(OH)2的物质的量是__________ mol
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为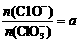 ,则n(C1-)= ___ mol(用含a的代数式来表示)。
,则n(C1-)= ___ mol(用含a的代数式来表示)。
26.(18分)用如下装置可以完成一系列实验(图中夹持装置已略去)。

请回答下列问题:
Ⅰ.若装置A中选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
|
B中棉花的位置 |
① |
② |
③ |
④ |
|
所蘸试剂 |
石蕊试液 |
品红溶液 |
淀粉和碘水混合液 |
氢硫酸 |
|
现象 |
|
|
褪色 |
浅黄色 |
|
体现SO2的性质 |
水溶液显酸性 |
漂白性 |
|
氧化性 |
II.若装置A中选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。请回答下列问题:
(1)写出用浓硫酸和浓盐酸混合制取HCl气体时,有利于HCl气体逸出的原因(写出两点) , 。
(2)反应开始后,观察到②处棉花变成棕黄色,则①处包有的某固体物质可能是 。a.KMnO4 b.KCl c.Cu
写出②处发生反应的离子方程式 。
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处的棕黄色褪去,产物之一为HIO3(强酸),写出该反应的离子方程式: 。k*s*5*u
25.(12分)已知NaBH4是一种强还原剂,其中B元素处于最高价态。解决下列问题:
(1)在60年代,德国拜尔药厂用下面的反应把NaBH4的生产发展成工业规模。请将下列反应方程式配平,各物质的计量数填入相应空格中:
1 Na2B4O7+ Na+ H2+ SiO2= NaBH4+ Na2SiO3
(2)NaBH4极易溶于水并与水反应产生H2,反应后硼以BO2-形式存在,则NaBH4与水反应的离子方程式为___________ ____;如果反应中转移2mol电子,则可生成标准状况下的H2为 L;
(3)在碱性条件下NaBH4不与水反应放出氢气,但可使许多金属离子还原成单质,反应后硼仍以BO2-形式存在。在冶金工业中,常用NaBH4处理含Au3+的碱性废液。如要处理800kg含Au3+ 0.197%的废液,则理论上需NaBH4的质量___________g。k*s*5*u
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com