
题目列表(包括答案和解析)

已知:
①反应原理:NaBr+H2SO4(较浓)△=== NaHSO4+HBr
HBr+C2H5OHC2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO4 30mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
|
|
密度/g·mL-1 |
沸点/℃ |
溶解性 |
|
溴乙烷 |
1.461 |
38 |
难溶于水 |
|
乙醇 |
0.789 |
78 |
易溶于水 |
回答下列问题:
(4)连接上述仪器的顺序是:1接( )接( )接( 4 )接( 3 )接( )(填数字)。你认为反应后溴乙烷在 (填“烧瓶”或“烧杯”)中
(5)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是 (写化学式),除去该杂质的试剂和方法是 ,为了减少该副产物的生成,本实验采取了 ____________________________________________________________的措施。
32. (16分)
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫、铁的化合物。
(1)黄铜矿的组成元素中,属于副族元素的是__________(填写名称,下同);属于主族元素的是_____,它位于周期表的位置是__________,它的原子半径________Cl的原子半径(填“>”、“<”或“=”,下同),它的气态氢化物的稳定性____HCl。
(2)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),氧化产物是___________(填化学式)。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2,通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (请配平)。
(1)应称取 g Na2CO3·10H2O。
(2)配制该溶液所用的仪器有 ____ 。
(3)下列操作使所配溶液浓度偏低的是( )
A、容量瓶未干燥即用来配制溶液 B、往容量瓶转移溶液时有少量液体溅出
C、未洗涤溶解固体的烧杯 D、定容时,仰视刻度线
24、(9分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示。
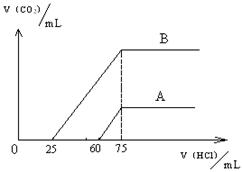
试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) __________________,其物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL(不考虑CO2的溶解,下同)。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式) _____________,其物质的量之比为 ;
(3)计算原NaOH溶液的物质的量浓度(写出计算过程)。
23.(10分)硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种,某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式,实验用到的仪器如下图所示:
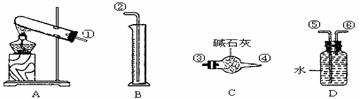
[提出猜想]
Ⅰ.所得气体的成分可能只含 一种;Ⅱ.所得气体的成分可能含有 二种;
III.所得气体的成分可能含有SO2、SO3、O2三种。
[实验探究]
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
(填序号);
(2)若实验结束,B中量筒没有收集到水,则证明猜想 正确;
(3)实验过程,仪器C的作用是 ;
(4)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
|
实验小组 |
称取CuSO4 的质量/g |
仪器C增 加的质量/g |
量筒中水的体积折算成标 准状况下气体的体积/mL |
|
① |
6.4 |
2.88 |
224 |
|
② |
6.4 |
2.56 |
448 |
请通过计算,推断出第①小组和第②小组的实验条件下CuSO4分解的化学反应方程式:
①组 ;
②组 。
22.(9分)A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B是第三周期中离子半径最小的元素,且其原子最外层电子数为D元素原子最外层电子数的一半。A元素原子最外层电子数比B多一个。甲、乙、丙是三种元素最高价含氧酸的钠盐,甲中含B元素,乙中含D元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
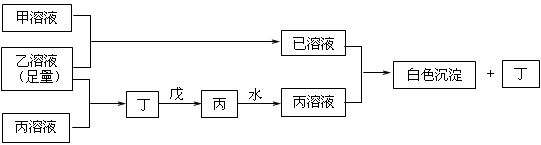
回答下列问题:
(1)元素B为: ,丁、戊的电子式分别为: . 。
(2)丁与戊反应的化学方程式 。
(3)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应;但生成物不是己和丁,
①写出将少量的乙溶液滴入甲溶液反应的离子方程式: 。
②写出将少量的乙溶液滴入丙溶液反应的离子方程式: 。
21.(9分)已知在酸性条件下有以下反应关系:
①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2;
2BrO3一+10I一+12H+=5I2+Br2+6H2O 6BrO3一+5I一+6H+=5IO3一+3Br2+3H2O
②Br2能将I一氧化为I2:Br2+2I一=2Br-+I2
③KIO3能将I-氧化为I2,也能将Br一氧化成Br2,其本身被还原为12。
IO3-+5I-十6H+=3I2+3H2O 2IO3-+10Br-+12H+=I2+5Br2+6H2O
(1)在上述反应涉及的粒字中氧化性最强的是 (填化学式,下同);
(2)在KI和KBr的混合溶液中,加入过量的KBrO3,其氧化产物为 ,还原产物为 ;
(3)向含有1 mol KI的硫酸溶液中加KBrO3溶液,①若反应后的碘元素只存在于I2中,溴元素只存在Br一中,则加入KBrO3的物质的量为 mol;②若反应后的碘元素只存在于I2中,溴元素只存在Br2 和Br一中,则加入KBrO3的物质的量范围为
(4)将等物质的量KBrO3溶液和KI溶液在稀H2SO4中混合。写出发生反应的离子方程式 。
20.( 9) 由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、 、NH4+、Mg2+、Ba2+、
、NH4+、Mg2+、Ba2+、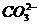 、
、 -。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
-。将该混合物溶于水后得澄清溶液,现取3份100mL该溶液分别进行如下实验:
实验序号 实验 内容 实验结果
内容 实验结果
1) 加AgNO3溶液 有白色沉淀生成
2) 加足量NaOH溶液并加热 收集到气体1.12L(已折算成标准状况下 的体积)
的体积)
3) 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 第一次称量读数为6. 27g,第二次称量读数为2.33g
试回答下列问题:
(1)根据实验1对C1-是否存在的判断是 (填"一定存在"、"一定不存在
"或"不能确定");根据实验1-3判断混合物中一定不存在的离子是
。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度:
阴离子符号 物质的量浓度分别
(3)试确定K+是否存在? ,判断的理由是
19、(8分)三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术创新必不可少的关键原料之一,可 由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。则:
(1)上述反应中,氧化剂与还原剂的物质的量之比为_________ _____;若反应中有0.5 mol NH3 被氧化,转移电子的数目为
。
_____;若反应中有0.5 mol NH3 被氧化,转移电子的数目为
。
(2)在潮湿的空气中,NF3 能与水蒸气发生氧化还原反应,其反应的产物有:HF、NO和HNO3 ,则在NF3、F2 、NO三种气体中,氧化性由弱到强的顺序 。
(3)一旦NF3 在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是 ______
18.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍。下列说法正确的是 ( )
A.X的氢化物溶于水显酸性
B.简单离子半径相比:Y>X>Z
C.Z的单质易溶于二硫化碳中
D.X和Z的最高价氧化物对应的水化物都是弱酸
第Ⅱ卷(非选择题,共54分)
17.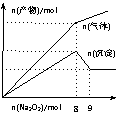 将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。则原溶液中Al3+、Mg 2+、NH4+的物质的量分别为 ( )
2+、NH4+的物质的量分别为 ( )
A.2 mol、3 mol、4 mol B.2 mol、2 mol、8 mol
C.2 mol、3 mol、8 mol D.3 mol、2 mol、4 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com