
题目列表(包括答案和解析)
5.分类是化学研究中常用的方法。下列分类方法中,正确的是 ( )
A.依据组成元素的种类,将纯净物分为单质和化合物
B.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
C.根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
D.根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
4.下列各项中的物质能导电且属于强电解质的是 ( )
A.固态氯化钠 B.熔融状态的氯化镁
C.氨水 D.冰醋酸
3.下列各项中表达正确的是 ( )
A.Si的原子结构示意图: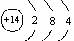
B.聚乙烯的结构简式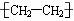 C.NH3的电子式:
C.NH3的电子式: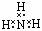
D.HCl的电子式: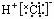
1.物质发生化学反应时,下列量值在反应前后肯定不发生变化的是 ( )
A.物质的种类 B.原子总数
C.分子总数 D.物质所具有的总能量
|
|
|
A.它是一种新元素 B.45Fe与56Fe 互为同素异形体
C.它是一种新原子 D.45Fe的中子数是26
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为 ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为 、 ;
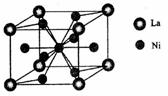
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ;
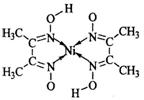
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 ,氮镍之间形成的化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子的杂化轨道类型有 。
20.下图为工业制备硝酸的设备示意图,其生产过程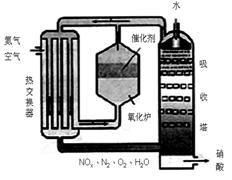 中发生的反应主要有:
中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g)+6H2O(l) △H<0
4NO(g)+6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
19.烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 。
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3  (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH = 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
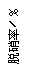
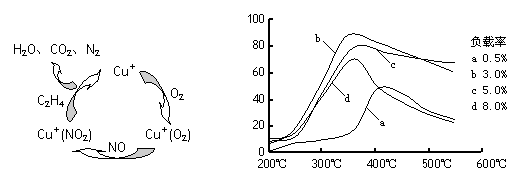

图1 图2
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
18.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
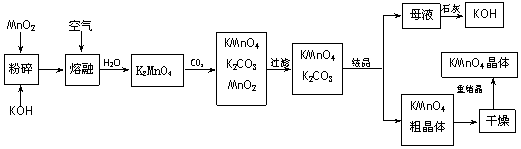
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列 (填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚
D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: 。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
17. (10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
(10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
请回答下列问题:
(1)C的电子式为 。
(2)检验溶液L中金属阳离子的方法是 。
(3)反应③的离子方程式为 。
(4)F与G的浓溶液反应的化学方程式为 。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为 。
16.(12分)课外化学兴趣小组欲测定铜锌合金粉末中锌的质量分数。
Ⅰ.除托盘天平必用外,供选择的实验装置如下:
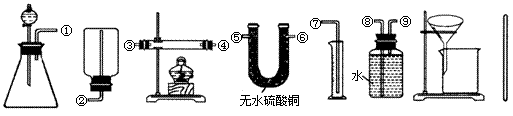
A B C D E F G H
Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4。
(1)实验时必须用到的化学试剂为 。
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为: 。样品中锌的质量分数的计算式为 。
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有 (填字母)。
(4)丙同学实验中只选用了A装置,他要测得的数据有 (填代号)。
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO。除测定m1外,还准备测定C装置反应前后的质量变化。请评价该方法是否可行并说明理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com