
题目列表(包括答案和解析)
6.下列离子或化学方程式与所述事实相符且正确的是
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.用K37ClO3
与浓盐酸反应制氯气:K37ClO3
+ 6HCl (浓)  K37Cl +
3Cl2↑+ 3H2O
K37Cl +
3Cl2↑+ 3H2O
C.向硝酸银溶液中滴加稀氨水至过量:AgNO3+NH3·H2O==AgOH↓+NH4NO3
D.亚磷酸是一种二元酸,向其中加入过量的烧碱溶液:H3PO3+2OH-=HPO32-+2H2O
5.下列各组物质中,物质之间通过一步就能实现如图所示的变化是
|
物质编号 |
物质转化关系 |
a |
b |
c |
d |
|
① |
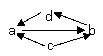  |
FeCl2 |
FeC13 |
Fe |
CuCl2 |
|
② |
NO |
NO2 |
O2 |
HNO3 |
|
|
③ |
CH2=CH2 |
CH3CH3 |
CH≡CH |
CH3CH2Cl |
|
|
④ |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
A.①②③④ B.①②③ C.①③④ D.②④
4.用NA表示阿伏加德罗常数的数值,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③1molC10H22分子中共价键总数为31NA ;
④在标准状况下,22.4LSO3的物质的量为1mol;
⑤7.8g过氧化钠中含有的离子数为0.3NA;
⑥标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA;
⑧在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA;
A.③⑤ B.①③⑤⑧ C.②④⑥⑦ D.③④⑤⑥
3.钛被誉为“未来钢铁”、“太空金属”,原因是它的强度大,密度小,抗腐性能好。室温下,它不与水、稀盐酸、稀H2SO4、稀HNO3作用,但易溶于氢氟酸,推测其原因是
A.氢氟酸的酸性比其他酸强
B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强
D.钛离子易与氟离子形成可溶性难电离物质
2.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是:①钠的化合物 ②能与硝酸反应的物质; ③可溶于水的物质;
④电解质; ⑤钠盐; ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥ C.②⑤⑥ D.①③④
1. 继毒大米、苏丹红、三聚氰胺到2010年4月的地沟油,江苏某地的“面粉加30%的生石灰粉”事件,折射食品安全监管疲软。下列有关说法不正确的是
A. 苏丹红、三聚氰胺、地沟油、生石灰粉都属对人体有害的有机物
B. 地沟油,经过提炼可作为化工原料
C. 地沟油是一种品质较差的动植物油脂,由于混有一些对人体有害杂质而不能食用。
D. 工业上可通过煅烧贝壳制得生石灰粉
3.第Ⅰ卷、第Ⅱ卷的答案都写在答题卡上,做在试卷上均无效;考试结束后,只交答题卡。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 Al 27 Fe 56 Cu 64 Na 23
第Ⅰ卷(选择题,共48分)
本卷共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一个选项是符合题目要求的。
2.答题前请将答题卡装订线内的项目填写清楚。
1.本试卷包括第I卷(选择题)和第II卷(非选择题)两部分,满分100分。考试时间100分钟。
27.(10分) 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 、MgO等,部分生产工艺流程图示意如下:
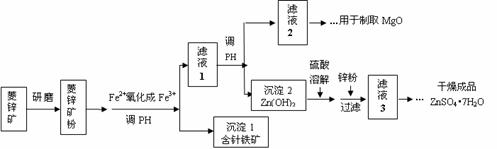
(1)将菱锌矿研磨成粉的目的是 。
(2)工业流程中必须将Fe2+氧化成Fe3+后再加以分离。在实验室中可以用H2O2,在酸性条件下完成这个转化,请写出相应的离子方程式:
。
(3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)工业上从“滤液2”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(5)“滤液3”之后的操作依次为 、 、过滤,洗涤,干燥。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com