
题目列表(包括答案和解析)
5. 设NA为阿伏加德罗常数的值,下列有关叙述中正确的是
设NA为阿伏加德罗常数的值,下列有关叙述中正确的是
A.标准状况下,密度为dg/L的某纯净气体一个分子的质量为
B.标准状况下,11.2LCCl4中含有的C-Cl键的数目为2NA
C.17g的氢氧根离子中含有的电子数为9NA
D.用100 mL 18.4 mol·L-1 的浓硫酸与足量的铜反应,生成SO2的分子数为0.92NA
4.下列各组离子在指定溶液中能大量共存的是
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
C.由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
D.有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3-
3.下列装置能达到实验目的的是




① ② ③ ④
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
2. 下列有关化学用语的说法中不正确的是
下列有关化学用语的说法中不正确的是
A.次氯酸的结构式为:H-Cl-O B.-OH 与 都表示羟基
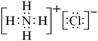

C.氯化铵的电子式: D.乙酸的分子比例模型为:
1.世界气候大会于2009年12月在丹麦首都哥本哈根召开。会议的主题是“促进低碳经济,
减少CO2的排放”。下列行为中不符合这一主题的是
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖
B.限制化工发展,关停化工企业,消除污染源头
C.加快研发利用二氧化碳合成聚碳酸酯类可降解塑料
D.推广煤的气化、液化技术,提供清洁燃料和化工原料
21.(11分)已知:①NaNO2具有强氧化性
②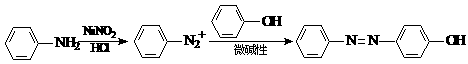
奥沙拉秦是一种抗菌药。其合成路线如下:
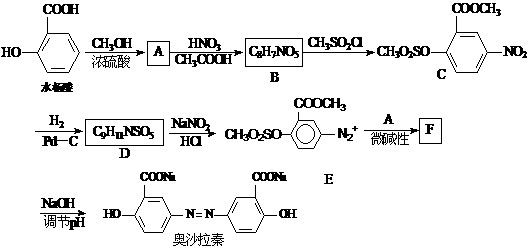
(1)写出下列反应的化学方程式:
水杨酸→A_____________________________________________;
A→B _________________________________________________。
(2)写出D的结构简式______________________。
(3)整个合成路线看,设计B→C步骤的作用是___________________________。
(4)F的结构简式为___________________。
 (5)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是
(5)有机物G(结构简式见下图)也可用于合成奥沙拉秦。它的一种同分异构体X是 -氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________。
-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子。X的结构简式为________________。
20.(12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定

① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
(3)若将H2换成CO,则还需补充 装置。
Ⅱ.铁矿石中含铁量的测定
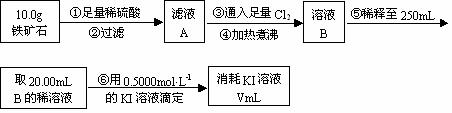
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有: 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(4)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
19. (9分) 某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了如下装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反应中的溶液体积变化)
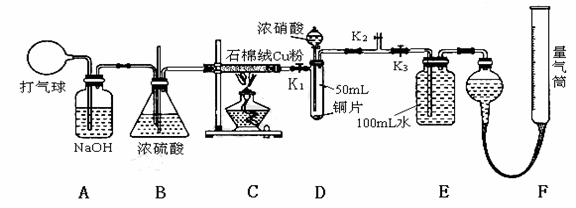 试回答下列问题:
试回答下列问题:
(1) 在铜和浓硝酸反应前,挤压打气球(球内充满空气),经A、B、C反应后,进入D中的气体主要成分是_________(填化学式),通入该气体的目的是____________;进行此步操作时应关闭_________,打开_________ (填K1、K2或K3)。
(2) 关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸。则D中一定发生反应的离子方程式为:_________ __________。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。
(3) I.从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol·L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则E容器中所得硝酸的物质的量浓度为__________________ mol·L-1。
Ⅱ.若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应___________(填“有”或“无”)NO生成,其依据是(请用数据和文字说明)______________ __________。
18.(8分)下列框图涉及到的物质所含元素中,除一种元素外,其余均为1-18号元素。已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)。

请回答下列问题:
(1)写出B与C反应生成E、F等的化学方程 。
(2)J、K是同种金属的氯化物,且K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(3)汽车尾气中常含有D。B在加热和催化剂存在的条件下能消除D的污染。已知:
 ①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
①4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
②4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
则B与D反应的热化学方程式为 。
(4)有人认为:“表面化学”研究成果能使B和D的反应在催化剂表面进行时的效率大大提高,从而使污染物D的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
17. (12分)有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
(12分)有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
(1)淡黄色粉末为_____________(填名称),溶液中肯定没有____________离子。
(2)当加入0.3mol淡黄色粉末时,生成气体成分是 , 物质的量之比是(假设生成的气体都能完全逸出) 。
(3)沉淀部分减少时的离子方程式为__________________________________。
(4)溶液中存在的各溶质阳离子及其物质的量分别是_________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com