
题目列表(包括答案和解析)
18、(共10分)
(1)BD (2分) (2)2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O (2分)
(3)K2MnO4 (2分)
(4)KOH、MnO2(各1分) (5)0.67或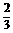 (2分)
(2分)
17、(共10分,每空2分)
(1)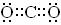
(2)向溶液中滴加KSCN溶液,滴加氯水,溶液变为红色
(3)Cl2+2H2O+SO2=4H++2Cl-+SO42-
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(5)SCO
16、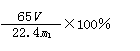 (共12分)
(共12分)
(1)稀硫酸 (1分) (2)①⑨⑧⑦ (2分) (2分)
(3)AGH (2分) (4)m1、m2、m3 (2分)
(5)不可行(1分)。因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量。(2分)
15、(共12分)
(2)Br2(2分) Fe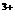 (2分)
(2分)
(3)b(1分) 下层(CCl4层)无色(1分); d(1分) 溶液变为血红色(1分)
(4)2 Fe2++ Br2=2 Fe3++ 2Br-(2分)
(5)4Fe2++2Br-+ 3Cl2=4Fe3++ Br2+6 Cl-(2分)
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为 ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm
和78 pm,则熔点NiO FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为 、 ;
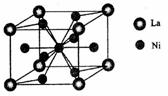
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为 ▲ ;
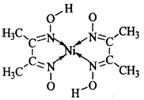
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉
淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 ,氮镍之间形成的化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子的杂化轨道类型有 。
[
无锡市2010年秋学期高中期中考试试卷
高三化学(选修)
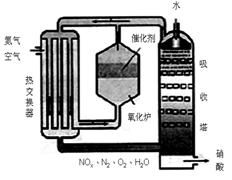
20.右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g)
+6H2O(l) △H<0
4NO(g)
+6H2O(l) △H<0
②2NO(g)+O2 (g) 2NO2(g) △H<0
2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l)
+NO(g) △H<0
2HNO3(l)
+NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度 B.适当增大吸收塔内的压强
C.增大空气中O2的浓度 D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应
达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数
K= 。
(3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产
硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。
回答下列问题:
①该工厂设备所生产硝酸的物质的量浓度是 。
②每小时从吸收塔淋下的水的质量应是多少吨?
19.烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 。
(2)选择性催化还原法的脱硝原理为:6NOx+4x NH3  (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO (g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH = 。
(3)目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
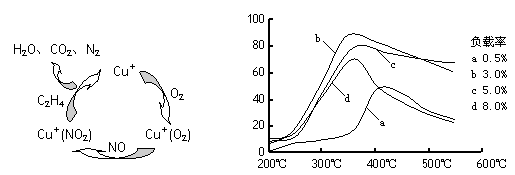

图1 图2
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
18.(10分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高
锰酸钾的一种工艺流程。
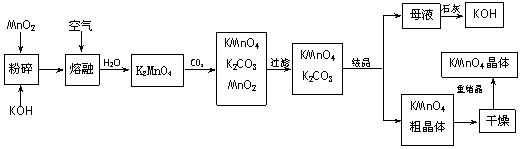
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列 (填序号)物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.84消毒液(NaClO溶液)
(2)写出MnO2、KOH的熔融混合物中通入空气时发生的主要反应的化学方程式:
。
(3)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是: 。
(4)上述流程中可以循环使用的物质有石灰、二氧化碳、 和 写化学式)。
(5)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
17.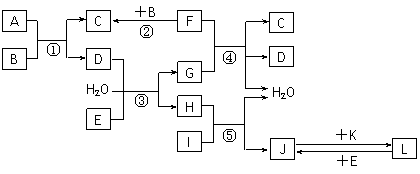 (10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
(10分)下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物。
请回答下列问题:
(1)C的电子式为 。
(2)检验溶液L中金属阳离子的方法是 。
(3)反应③的离子方程式为 。
(4)F与G的浓溶液反应的化学方程式为 。
(5)气体A的密度为2.68g·L-1(标准状况),通过计算、推理,可确定A的分子式为 。
16.(12分)课外化学兴趣小组欲测定铜锌合金粉末中锌的质量分数。
Ⅰ.除托盘天平必用外,供选择的实验装置如下:
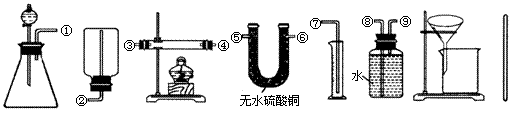
A B C D E F G H
Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总
质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4。
(1)实验时必须用到的化学试剂为 。
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为: 。样品中锌的质量分数的计算式为 。
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有 (填字母)。
(4)丙同学实验中只选用了A装置,他要测得的数据有 (填代号)。
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO。除测定m1外,还准备测定C装置反应前后的质量变化。请评价该方法是否可行并说明理由: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com