
题目列表(包括答案和解析)
4.下列离子方程式的正误判断及评价均正确的是
|
|
离子反应 |
离子方程式 |
判断及评价 |
|
A |
在NH4HCO3溶液中加少量NaOH加热 |
NH4++OH- =NH3·H2O |
错误,加热条件下应生成氨气 |
|
B |
在FeI2溶液中加少量的溴水 |
2I-+Br2=I2+2Br- |
正确,还原性I-大于Fe2+ |
|
C |
在NaAlO2溶液中通入少量的CO2气体 |
2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
错误,应生成HCO3- |
|
D |
在稀硝酸中加入少量的铁粉 |
3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
正确,稀硝酸的还原产物为NO |
3.设NA为阿伏加德罗常数的值,下列说法错误的是
A.6.2g白磷(P4)分子含有的P-P键数目为0.3NA
B.23.4gNa2O2固体中含有的阴离子数目为0.3 NA
C.标准状况下,2.24LNO2气体溶于水,转移的电子数为0.3 NA
D.常温常压下,4.2g乙烯和丙烯的混合气体中含有的碳原子数为0.3NA
2.下列说法正确的是
A.H、D、T属于同位素,H2、D2、T2属于同素异形体
B.氯水、氨水、王水是混合物,水银、水玻璃、水杨酸是纯净物
C.HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质
D.水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
1.升高温度,下列数据不一定增大的是
A.化学反应速率v B.水的离子积常数Kw
C.化学平衡常数K D.弱电解质的电离平衡常数Ka
32.我国推广食用加碘盐。根据GB5461--《国家食用盐标准》,碘元素含量为
20-50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:
称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,
生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去24mL。有关反应
如下:(未配平)
①IO3-+I-+H+-I2+H2O ②I2+S2O32--I-+S4O62-
(1)写出配平了的上述两个反应方程式 、 ;
(2)用硫代硫酸钠溶液滴定I2时,应用 作指示剂,滴定到终点
的现象是 ;
(3)试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
 2010年下学期南马高中期中考试试卷
2010年下学期南马高中期中考试试卷
31.化学反应速率与化学平衡在日常生活、工农业生产和科学研究中具有重要的意义,在
化学实验中涉及的电离平衡也属于化学平衡。请回答下列问题:
(1)某研究性学习小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二
氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了
定量对照实验。实验时均以收满500 mL氧气为准(其他可能影响实验的因素均已
忽略)。
表一 用MnO2作催化剂
|
实验序号 |
KClO3质量/g |
MnO2质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
表二 用A作催化剂
|
实验序号 |
KClO3质量/g |
A的质量/g |
反应温度/℃ |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一研究报告的标题:
。
(2)氨水是一种弱碱,某同学取0.1mo/L的氨水,用pH试纸测其pH,结果发现溶液的
pH约为11,以此得出氨水为弱碱的结论。该同学用pH试纸测定氨水pH的具体操
作是 。
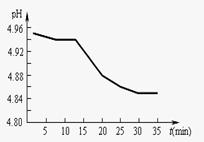
(3)证明氨水是弱碱的常用方法还有两种:一是设法证明NH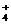 的水解,一是设法使氨水
的水解,一是设法使氨水
电离平衡发生移动。
方法一:取少量NH4Cl晶体溶于水,滴入石蕊试液,溶液变红,可见溶液显酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞变红后再加入 ,振荡,红色变浅,c(OH-)下降,说明氨水的电离平衡向 移动。
30.(1)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,
但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、
CuSO4、PH3、H3PO4、H2O。回答下列问题:
①上述反应体系中化学反应方程式为 ;
②膦(PH3)在水中的溶解度远小于氨的原因是 。
 (2)SO2的排放是造成酸雨的主要因素。某地区酸雨
(2)SO2的排放是造成酸雨的主要因素。某地区酸雨
pH随时间的变化如下图所示。请用化学方程式
表示该地区酸雨pH随时间增加而减小的原因
。
(3)生活污水中含大量细小的悬浮物,可加入某些
物质使之聚集成较大的颗粒而沉淀。请你举一
种常见的能使生活污水中悬浮物聚沉的物质,
其化学式为 。若生活污水中含
大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将
NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化
为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
(4)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574
kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
若1molCH4还原NO2至N2,整个过程中放出的热量为867kJ,则ΔH2= 。
29.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+≒2Fe2++I2(水溶液)
(1)当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移
动(选填:向右、向左、不)。
(2)上述反应的正向反应速度和I-Fe3+的浓度关系为:υ=κC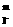 C
C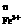 (κ为常数)
(κ为常数)
|
|
C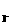 (mol/L) (mol/L) |
C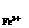 mol/L. mol/L. |
mol/L·s. |
|
(1) |
0.20 |
0.80 |
0.032κ |
|
(2) |
0.60 |
0.40 |
0.144κ |
|
(3) |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算得知:在υ=κC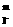 C
C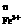 中。M、n的值为 [选填(A)、
中。M、n的值为 [选填(A)、
(B)、(C)、(D)]
(A)m=1,n=1 (B)m=1,n=2 (C)m=2,n=1 (D)m=2,n=2
I-浓度对充应速度的影响 Fe3+浓度对反应速度的影响。(选填:小于、大于、等于)
28.在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变
2NO2(g)体系中,n(NO)随时间的变
化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知: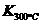 >
>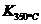 ,则该反应是
热反应。
,则该反应是
热反应。
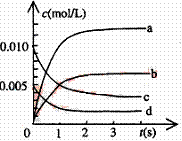 (2)右图中表示NO2的变化的曲线是 。
(2)右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v=
。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方
向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
27.已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O 乙+丙 b.乙
乙+丙 b.乙 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红
棕色粉末,则该金属在周期表中的位置是 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为
_ 。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,
则负极发生的电极反应为 。
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单
质,甲和丙均为气态化合物,且可发生反应:甲+乙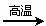 丙。
丙。
则:①甲的结构式为 。
②写出上述反应的化学方程式 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生
完全反应的总离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com