
题目列表(包括答案和解析)
5、已知阿伏伽德罗常数为NA,下列说法中正确的是( )
A.常温常压下,当活泼金属转移2NA电子时,可从盐酸中置换产生22.4L H2
B.100g98% 的浓硫酸中含有氧原子个数为4NA
C.CO与N2具有相同的电子总数,那么1molN2和22.4L的 CO气体所含有的电子总数为28NA
D.室温下,21.0g乙烯和丁烯(C4H8)的混合气体中含有的碳原子数目是1.5NA
4、下列离子反应方程式改写的化学方程式正确的是( )
A.Mg2++2OH-=Mg(OH)2↓ MgCO3+2NaOH=Mg(OH)2↓+Na2CO3 B.Ba2++SO4 2 -=BaSO4↓ Ba(OH)2+H2SO4=BaSO4↓+2H2O C.Ca2++OH -+HCO3 - =CaCO3↓+H2O Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3
D.Cu +2Fe3+=Cu2++2Fe2+ Cu +2FeCl3=2FeCl2+CuCl2
3、室温下,某无色透明溶液可以使氢氧化铝溶解,则此溶液中可能大量共存的离子组为( )
A.HCO3- 、Al3+、Na+、SO42- B.I -、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42 -、K+ D.SiO32 -、SO32-、Na+、Cl-
2、用下列装置及实验设计不能达到实验目的的是( )
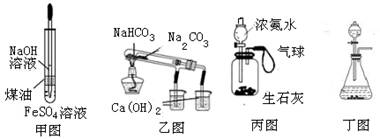
A.用甲图装置制备少量的氢氧化亚铁
B.用乙图装置验证NaHCO3和Na2CO3的热稳定性
C.用丙图装置可以实现使气球膨胀
D.用丁图装置可以用于实验室制取氧气
1、2010年“中国水周”的主题是“关注水质、抓住机遇、应对挑战”。我们应该了解水、爱护水资源。下列说法错误的是( )
A.为使水中的悬浮杂质沉降,可在水中加人适量的明矾
B.通过过滤的方法可以将不溶于水的固体杂质与水分离开来
C.铁可以和热水发生反应,并且可以生成氧化铁
D.5mL水和5mL酒精混合,溶液体积小于10mL,说明分子间有空隙
31.现有等物质的量的KHCO3和NaHCO3的混合物a g与2 mol/L盐酸反应。题中涉及到的气体均以标准状况计。填空时,可用带字母的分式表示。
(1)该混合物中KHCO3和NaHCO3的质量比为______________。
(2)如果该混合物与盐酸恰好完全反应,则所用盐酸的物质的量是____________。
(3)如果盐酸过量,则生成CO2的体积是为______________L。
(4)如果反应后,混合物有剩余,盐酸量不足,除上述已知条件外,还应知道下列条件中的______________,才能计算生成CO2的体积。
A.盐酸的体积 B.盐酸的密度和质量分数 C.盐酸的质量
(5)如果KHCO3和NaHCO3不是以等物质的量混合,a g固体混合物与足量盐酸完全反应生成CO2,求CO2的体积(V)的取值范围,写出简明的计算过程。
|

|
版权所有:()
版权所有:()
 上海交通大学附属中学2010-2011学年度第一学期
上海交通大学附属中学2010-2011学年度第一学期
30.氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl:
2CuSO4+Na2SO3+2NaCl+Na2CO3 → 2CuCl↓+3Na2SO4+CO2↑
⑴CuCl制备过程中需要配制质量分数为20.0%的CuSO4溶液,则配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
⑵准确称取0.2500 g CuCl样品,放到足量的0.5 mol/L FeCl3溶液中,待样品完全溶解后,加水20 mL,用0.1000 mol/L的Ce(SO4)2溶液滴定到终点,消耗24.60 mL Ce(SO4)2溶液。有关反应为:
Fe3++CuCl → Fe2++Cu2++Cl- ; Ce4++Fe2+ → Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是 ,
是否符合标准: (选填“是”或“否”)。
29.丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂;
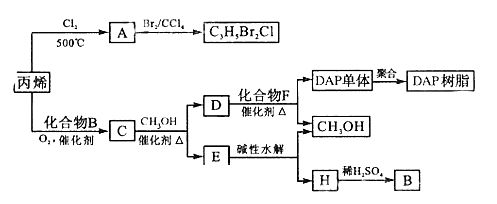
已知醇与酯可发生如下酯交换反应:
RCOOR’+R”OH RCOOR”+R’OH(R、R’、R”代表烃基)
RCOOR”+R’OH(R、R’、R”代表烃基)
(1)农药C3H5Br2Cl分子中每个碳原子上均连有卤原子。
①A的结构简式是 , A含有的官能团名称是 ;
②由丙烯生成A的反应类型是
(2)A水解可得到D,该水解反应的化学方程式是 。
(3)C蒸汽密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%,则C的结构简式是 。
(4)下列说法正确的是(选填序号字母)
A.C能发生聚合反应、还原反应和氧化反应
B.C含有2个甲基的羧酸类同分异构体有4个
C.D催化加氢的产物与B具有相同的相对分子质量
D.E有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用DAP树脂的制备。其中将甲醇与H分离的操作方法是
(6)F的分子式为C10H10O4,DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是
。
28.化合物H是一种香料,存在于金橘中,可用如下路线合成:
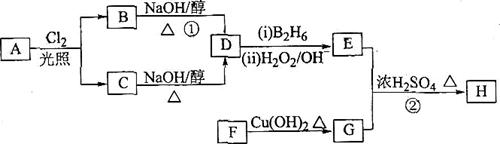
已知: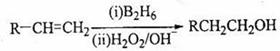 (B2H6为乙硼烷)。
(B2H6为乙硼烷)。
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧生成88gCO2和45gH2O。
则A的分子式是 ;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为
、 ;
(3)在催化剂存在下1mol F与2mol H2反应生成3-苯基-1-丙醇。F的结构简式是
(4)反应①的反应类型是 ,
(5)反应②的化学方程式为 ,
(6)写出所有与G具有相同官能团的G的芳香族同分异构体的结构简式:
27.工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另取铁钉6.0g放入15.0mL浓硫酸中加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。若检验其中Fe2+,应选用的试剂为 (选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 C..浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,
发生反应: SO2+Br2+2H2O=2HBr+H2SO4 然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为 。
[探究二] 分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
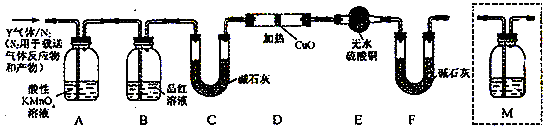
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有H2,预计实验现象应是 。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com