
题目列表(包括答案和解析)
4.在一次课堂检测中,几位同学所写反应的离子方程式如下,你认为其中正确的是
A.氢氧化钡溶液与稀硫酸等物质的量混合 H++OH-====H2O
B.小苏打溶液与稀硫酸混合 CO +2H+==== CO2↑+H2O
+2H+==== CO2↑+H2O
C.大理石溶解于醋酸 CaCO3+2H+====Ca2++CO2↑+H2O
D.明矾溶液加热水解生成沉淀 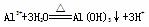
3. 在pH=1含Ba2+ 离子的溶液中,还能大量存在的离子是
A.AlO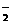 B.ClO-
C.Cl-
D.SO
B.ClO-
C.Cl-
D.SO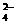
2.经检测发现保存已久的无色KI晶体中出现了很多紫黑色的小颗粒,则可推断空气中使KI变质的最有可能的物质是
A.H2O B.CO2 C.N2 D.O2
1.金属钠不宜用于制备下列哪种物质
A.过氧化钠 B.金属钾 C. 金属钛 D.氯化钠
27、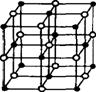 (6分)晶体具有规则的几何外形,晶体中最基本的重复单位称晶胞。氯化钠晶体结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7.4g/cm3,晶胞边长为4.0×10-10m(NA用6.0x1023计算)。试回答(要求计算过程):
(6分)晶体具有规则的几何外形,晶体中最基本的重复单位称晶胞。氯化钠晶体结构如图所示,已知NixO晶体晶胞结构为氯化钠型,由于晶体缺陷,x值小于1,测知NixO晶体的密度为7.4g/cm3,晶胞边长为4.0×10-10m(NA用6.0x1023计算)。试回答(要求计算过程):
(1)NixO晶体中的x值_________(精确到0.01)。


(2)晶体中的Ni分别为Ni2+、Ni3+,此晶体化学式____________
(用含Ni2+、Ni3+表示)。
河北正定中学2010-2011学年第一学期第二次考试
26、(12分) 将2mol X和1mol Y的混合气体置于等压密闭容器中,此时容器的体积为120 L,在一定温度下发生反应:2X(g)+Y(g) 2Z(g)。当反应达到平衡状态A时,测得气体的密度变为反应前的1.2倍。请回答下列问题:
2Z(g)。当反应达到平衡状态A时,测得气体的密度变为反应前的1.2倍。请回答下列问题:
(1)达平衡状态A时,Y的转化率为________,容器的体积为_________;在达到平衡状态A的容器中通人少量Y,体系中X的体积分数将_______(填“增大”或“减小”或“不变”)。
(2)若在同一容器中起始加入X、Y、Z分别为a、b、c mol,达到平衡后Y的体积分数与平衡状态A相同,则起始时a、b、c应满足的关系为___________、___________。
(3)若反应在一体积为120 L的等容密闭容器中进行,要使平衡后各气体体积分数与平衡状态A相同,则起始时应加入X:_________mol,Y:_________mol,Z:0 mol。
25、(12分)有关元素A、B、C、D的信息如下:
|
元 素 |
有关信息 |
|
A |
最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
|
B |
地壳中含量最高的元素,A与B可形成一种质量比为 7︰12的化合物(丙) |
|
C |
单质曾用于焊接钢轨 |
|
D |
单质是生活中常见金属,其制品在自然环境中被腐蚀呈现红棕色 |
请回答下列问题:
(1)乙分子的空间构型________,用电子式表示乙的形成过程____________________。
(2)有关C与D元素,下列说法正确的是____________________ (填序号)。
① C或D的高价盐均可用做净水剂
② 用C或D单质做成的槽车,都可用来运输甲的稀溶液
③ C、D的单质与稀硫酸组成的原电池,C电极发生氧化反应
④ C的合金可用来做车船材料和门窗等
(3)B的一种氢化物在碱性溶液中可与丙反应,生成物中A元素只显其最高价态,该反应的离子方程式是________________________________________。
(4)现取1 mol/L 100 mL的C的氯化物溶液,向其中加入1 mol/L氢氧化钠溶液产生了3.9 g的沉淀,则加入的氢氧化钠溶液体积可能是____________________mL。
(5)已知:2AB2(g) 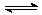 A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
A2B4(g);△H<0。在恒温恒容条件下,将一定量AB2和A2B4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
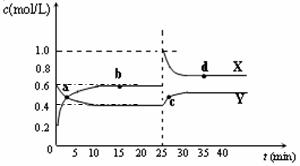
① a、b、c、d四个点中,化学反应处于平衡状态的是_______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
24、(8分)某无色溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、
SO42-中的若干种组成,取该溶液进行如下实验:
(a)取适量溶液,加入过量盐酸,有气体生成,并得到无色透明溶液;
(b)向(a)所得溶液中加入过量碳酸氢铵溶液,有气体生成,且析出白色沉淀甲;
(c)向(b)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是____________________。
(2)溶液中一定存在的离子是____________________。
(3)判断沉淀乙成分的方法是______________________________。
23、(10分)下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500 mL的操作,请按要求填空:
(1)如果实验室有15mL、20mL、50mL量筒,应选用_____mL量筒最好。量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将________
(偏高、偏低、无影响)。
(2)将量取的浓H2SO4沿玻璃棒慢慢注入盛有约100mL水的_______里,并不断搅拌,目的是________________________________。
(3)将___________________________的上述溶液沿___________注入______
_____________中,并用50mL蒸馏水洗涤烧杯2-3次,洗涤液要 ________________中,并摇匀。
(4)加水至距刻度线___________处,改用____________加水,使溶液的凹液面正好跟刻度相平。
22、(4分)某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是________。
(2)该反应中,发生还原反应的过程是________→________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目(用单线桥法)。
__________________________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com