
题目列表(包括答案和解析)
1、为“绿色奥运”某同学提出了下列环保建议,共中你认为可以采纳的是 ①研制开发燃料电池汽车,消除机动车尾气污染;②开发生产无汞电池; ③提倡使用一次性发泡塑料餐具和塑料袋; ④分类加收垃圾; ⑤开发无磷洗涤剂; ⑥为使农作物高产,大量施用化肥和农药 A.①②④⑥ B.②③④⑤ C.①②④⑤ D.全部
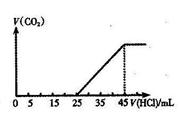
23、将2.5gNa2CO3、NaHCO3和NaOH组成的固体混合物加入足量水溶解配成溶液。然后向此溶液中滴加1.0mol/l的盐酸。所加盐酸的体积与产生的CO2的体积关系如右图:
(1)该溶液中存在的溶质是 (填化学式)
(2)当加入35ml盐酸时,产生CO2的体积为 ml(标准状况)
(3)原固体混合物中Na2CO3的质量为 克
22.由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去):
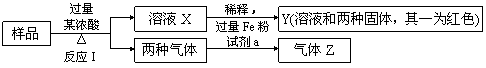
(1)取少量溶液X,加入过量的NaOH溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有的物质是(填写化学式)_________。
(2)Z为一种或两种气体:
①若Z只为一种气体,试剂a为饱和NaHCO3溶液,则反应I中能同时生成两种气体的化学方程式是_____________________________________。
②若Z为两种气体的混合物,试剂a为适量水,则Z中两种气体的化学式是_________。
 (3)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 molI-时,共转移3 mol电子,该反应的离子方程式是______________。
(3)取Y中的溶液,调pH约为7,加入淀粉KI溶液和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2 molI-时,共转移3 mol电子,该反应的离子方程式是______________。
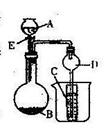
21.双峰一中某学习小组设计了如下所示装置进行下列有关 实验。实验时将分液漏斗中A逐滴加入烧杯中(图中铁架台、铁夹等已略去)。
(1)若A为浓硫酸,B为第三周期元素组成的片状单质,B在常温下难与水反应,C为品红溶液,试验中观察到溶液红色褪去,则此时烧杯中A与B发生的化学反应方程式为
(2)若A为稀盐酸,B为块状大理石, C为Na2CO3饱和溶液,实验中观察到小试管内溶液变浑浊,则烧杯中反应的离子方程式为
(3)若A为浓氨水,B为生石灰,实验中观察到C(为铝盐溶液)中生成白色沉淀,该沉淀既能溶于烧碱,又能溶于稀盐酸,则烧瓶中发生的化学反应方程式为
C中生成的沉淀与烧碱反应的离子方程式为
20.短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知: a.常见双原子单质分子中,X分子含共价键最多。
 b.甲分子中含10个电子,乙分子含有18个电子。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
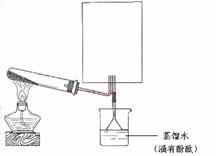
(2)实验室可用右图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
 (4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是
。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是
。
19.已知A、B、C、D均为短周期元素,它们的 原子序数依次增大。A是原子最外层有一个电子的非金属元素,C原子的最外层电子数是次外层电子数的3倍;C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可形成离子化合物,该化合物中各元素原子的物质的量之比为n(A)∶n(B)∶n(C)=4∶2∶3。请回答下列问题:
(1)写出C和D形成的淡黄色固体化合物的电子式:__________。
(2)各元素原子的物质的量之比为n(A)∶n(B)∶n(C)=4∶2∶3 的化合物的水溶液呈________性。
(3)请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两 种元素组成的粒子的符号(举两例)___ _____ ________。
(4)写出由B、C元素组成的元素原子质量比为n(B)∶n(C)=7∶12的化合物的化学式________。
18.有一瓶澄清的溶液,其中可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、NO3- 、Cl-、I-,取该溶液进行如下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置CCl4层呈紫红色;
(3)取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
(4)取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
(5)将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
在溶液中肯定存在的上述离子有 ,
肯定不存在的上述离子有 。
17. “绿色试剂”双氧水可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如KCN),反应的化学方程式为:KCN+H2O2+H2O== A+NH3↑ 回答下列问题:
⑴生成物A的化学式为 。
⑵在标准状况下有0.448L氨气生成,则转移的电子数为 。(已知阿伏伽德罗常数为NA)
⑶H2O2被称为“绿色试剂”的理由是 。
16、有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通人氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)
A.7:1 B.7:2 C.7:3 D.7:4
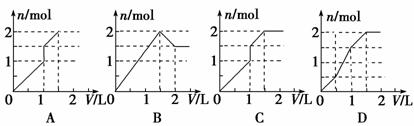
15.向含1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol·L-1的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com