
题目列表(包括答案和解析)
3. 下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用热化学方程有关计算规律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
2.下列有关化学研究的正确说法是 ( )
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应热是相同的
C.依据丁达尔效应可将分散系分为溶液、胶体与浊液
D.从HF、HCI、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律
1.诺贝尔化学奖获得者Gerhard Ertl在表面化学研究领域取得了开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
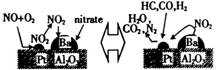 A. 汽车尾气催化转化机理
A. 汽车尾气催化转化机理
B. 钢铁生锈机理
C. 合成氨工业催化机理
D. 氢氧燃烧电池电极反应机理
29、(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y
的单质是生活中常见的金属,相关物质间的关系如下图所示。
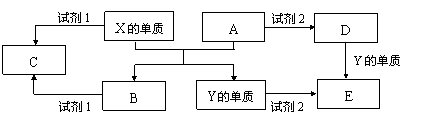 (1)X的单质与A反应的化学方程式是
。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是
。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
。
30、(7分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50mL1mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。
(1)X的单质与A反应的化学方程式是
。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是
。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)
。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
。
30、(7分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加 入50mL1mol·L-1的盐酸,可恰好使反应过程中产生的沉淀刚好消失。
(1)填写下列空格:
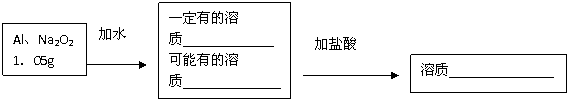
(2)铝的质量为 g
27、(8分)W、X、Y、Z均为短周期主族元素,W的最外层电子数与核外电子总数之比为3:8;X的核外电子总数与Y的最外层电子数相等,X的原子序数是Z的原子序数的一半;W、Y、Z位于同一周期。
(1)W的单质是一种_________色晶体。
(2)W、Y、Z三种元素的气态氢化物稳定性由高到低的顺序是
(用化学式表示,Z的气态氢化物与其同主族元素气态氢化物化学式写法相似。)。
(3)已知A、B、C、D四种物质存在如下反应关系:
A + B→C + D
①若A是Y和Z常见价态的化合物,B是X的氢化物,D是Y的氢化物,反应过程中没有化合价变化,该反应的化学方程式是
。
②若A是Z的单质,B为红色固体,D为紫红色固体单质,高温下发生该反应,C的化学式是
。D与X元素最高价氧化物对应水化物的浓溶液反应,生成的气体会对大气造成污染。用烧碱溶液吸收该气体生成两种盐,其中一种盐可用作防腐剂,烧碱溶液吸收气体的离子方程式是
。
28、(13分)下列物质有如下转化关系(有的反应物生成物未列出),其中:D为碱,G为酸,金属甲在G的浓溶液中会钝化;F的溶液中只含一种溶质。
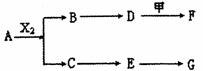 A、B、C、D,E均由Q,R、x、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素。则:
(1)X在周期表中的位置是
,R、X、T的原子半径从小到大的顺序为
(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显
性,其原因用离子方程式表示为
;
(3)A和X2反应的化学方程式为
;
(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移l mol电子时,生成的气体在标准状况下的总体积为
L。
A、B、C、D,E均由Q,R、x、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素。则:
(1)X在周期表中的位置是
,R、X、T的原子半径从小到大的顺序为
(用元素符号表示);
(2)A和G等物质的量反应产物的水溶液显
性,其原因用离子方程式表示为
;
(3)A和X2反应的化学方程式为
;
(4)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移l mol电子时,生成的气体在标准状况下的总体积为
L。
26、(12分)氯及其化合物是中学化学中的重要研究对象。
(1)写出实验室中制取氯气的离子方程式 ;
(2)实验室也可以利用如下反应制取氯气:KC1O3+6HC1(浓) KC1+3C12↑+3H2O。若制取标准状况下的6.72L氯气,该反应中电子转移的物质的量为
;
(3)某同学用排空气法收集一瓶氯气,进行氯气与铁反应的实验:取一根细铁丝 ,然后立即伸入充满氯气的集气瓶中,观察到的现象是 。为观察生成的氯化铁溶液的颜色,向反应后的集气瓶中加入少量的蒸馏水,振荡,实际观察到的现象是 ,产生这种现象的原因是 ;为真正观察到氯化铁溶液的颜色,应向反应后的集气瓶中改加(填试剂名称) 。
25、下列说法正确的是
A、强氧化物与强还原剂一定能发生氧化还原反应
B、弱电解质被稀释时,离子浓度一定减小
C、1 mol某气体的体积是22.4 L,该气体所处的状态一定是标准状态
D、有单质参加或生成的化学反应不一定是氧化还原反应
第II卷(非选择题,共50分)
24、在雷达的微波过滤器里使用的铁氧磁性体,如钇铁石榴石Y3Fe5O12,其中Y是ⅢB族稀土元素。下面有关钇铁石榴石的叙述中正确的是
A、可表示为3YO3·3FeO·Fe2O3 B、可表示为Y3O5·Fe3O4·Fe2O3
C、其中钇、铁的化合价均为+3价 D、其中钇、铁的化合价均有+2、+3价
23、一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。
则下列叙述正确的是
A.ZnI2既是氧化产物,又是还原产物
B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
22、下列金属或氧化物可以完全溶解的是
A、1 mol Zn与含1 mol HCl的稀盐酸共热
B、1 mol Cu与含2 mol H2SO4的浓硫酸共热
C、1 mol Cu与含4 mol HNO3的浓硝酸
D、1 mol MnO2与含4 mol HCl的浓盐酸共热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com