
题目列表(包括答案和解析)
1.质子核磁共振(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一个结构中的等性氢原子的PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的等性氢原子数成正比。现有某种有机物,通过元素分析得到的数据为C:85.71%,H:14.29%(质量分数),质谱数据表明它的相对分子质量为84。
(1)该化合物的化学式为_____________。
已知该物质可能存在多种结构,A、B、C是其中的三种,请根据下列要求填空:
(2)A与氢气加成生成2-甲基戊烷,则A的可能结构有___________种。
(3)B能使溴水和酸性高锰酸钾褪色,PMR谱中只有一个信号,则B的结构简式为:________________________
(4)C不能使酸性高锰酸钾溶液褪色,不能与溴水加成褪色,可萃取溴水中的溴;PMR谱中也只有一个信号,则C的结构简式为:____________________________
3.下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1 : 1,但I晶体中阴、阳离子个数比是2 : 1,I常用作干燥剂。其中E、F均为气体单质,N与J两种气体相遇产生白烟。
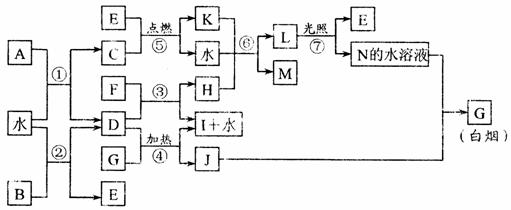
请按要求填空:
(1)G的电子式是_________________。
(2)反应⑥的化学方程式是
_____________________________________,
物质C在空气中点燃时发生的现象是___________________,
已知C的燃烧热是1300 kJ · mol – 1,表示C燃烧热的热化学方程式是_____________________________________________________________。
(3)根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是____________。
2.X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化:
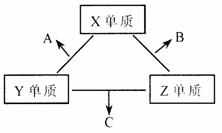
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是_________周期_________族。
(2)分析同主族元素性质的递变规律,发现B、C物质的沸点反常,这是因为它们的分子之间存在_________。
(3)①C的电子式是________________,C分子的结构呈________形。
②C在一定条件下反应生成A的化学方程式是__________________________。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH________7(填“大于”、“于小”、“等于”),其原因是(写出离子方程式)__________________________。
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H < 0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有_________。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大
1.已知离子化合物A由两种短周期元素组成,且A中阴阳离子的电子层结构相同。从固体A开始,可以发生如下框图变化,已知[Cu(H)4]2+(H为图中气体)离子在溶液中呈深蓝色。
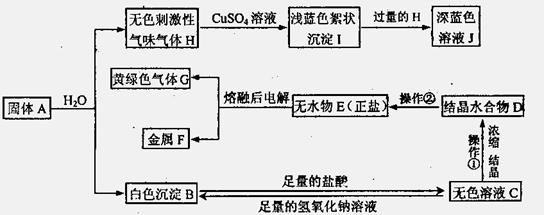
(1)在实验室用集气瓶收集气体G和气体H。则收集气体G的方法是(写一种): ;检验气体H已收集满方法是: 。
(2)在实验室进行操作①时,除了使用酒精灯、铁圈、铁架台及夹持仪器外,还缺少的仪器是: ;在进行操作②时,应在HCl的气氛中加热脱水,其目的是:
。
(3)A+H2O→B+H的基本反应类型为 ,H的电子式为 。
2.某校课外实验小组同学设计下图装置进行实验(夹持装置已略去)。

(1)该小组同学用上图装置进行“乙炔的制取及燃烧性质验证”实验。
①制取乙炔的化学方程式是______________________________;
②点燃乙炔前,需要验纯。简述检验可燃气体纯度的操作方法:_______________________________________________________________。
③在导管口c处点燃乙炔,观察到的现象是______________________;
(2)上图装置还可用于制取并收集少量其他气体。请帮助该小组同学完成表1。
|
制取的气体 |
药 品 |
化学方程式 |
|
O2 |
________、_______ |
_____________________________ |
|
_________ |
某溶液、Al |
_____________________________ |
表1
(3)该小组同学用上图装置进行实验,确定某饱和醇的结构。
①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是________________________________________,并使视线与凹液面最低处相平。
②实验数据记录如下:(表2中读数已折合成标准状况下的数值)
|
|
饱和醇的质量 |
金属钠的质量 |
量气管第一次读数 |
量气管第二次读数 |
|
① |
0.62
g |
5.0
g(足量) |
40 mL |
264 mL |
|
② |
0.31
g |
2.5
g(足量) |
40 mL |
152 mL |
表2
已知该饱和醇的相对分子质量为62。根据上述数据可确定该饱和醇是_______元醇。
1.(1)下列有关化学实验的操作或说法中,正确的是(填写字母代号)
A、实验室制取肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
B、进行中和热测定实验时,需要测出反应前盐酸与NaOH溶液的各自温度及反应后溶液的最高温度
C、检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置到充分沉淀后,取上层清液于试管中,滴加KSCN溶液2~3滴即可
D、制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得到硫酸亚铁晶体
E、进行纤维素水解实验时,把一小团脱脂棉放入试管中,滴入少量90%的浓硫酸搅拌,使脱脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu (OH)2加热至沸腾即可
(2)下面a-e是中学化学实验中常见的几种定量仪器:
a、量筒 b、容量瓶 c、滴定管 d、托盘天平 e、温度计
①使用容量瓶的第一步操作是___________________________________。
②若用上述仪器配制500mL 2mol·L-1的NaCl溶液,还缺少的玻璃仪器是烧杯_________。
③若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯、__________。
④若用上述仪器进行中和滴定,则缺少的仪器是__________。
18.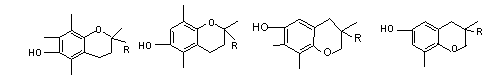 维生素E是一种酯溶性维生素,有抗衰老的特殊作用。维生素E有四种类型,其结构简式如图所示[R为(CH2)3CH(CH3)(CH2)3CH(CH3)(CH2)3CH(CH3)2]。下列说法中,正确的是
维生素E是一种酯溶性维生素,有抗衰老的特殊作用。维生素E有四种类型,其结构简式如图所示[R为(CH2)3CH(CH3)(CH2)3CH(CH3)(CH2)3CH(CH3)2]。下列说法中,正确的是
A.四种维生素E均能与溴水反应
B.四种维生素E均能与烧碱溶液反应
C.四种维生素E互为同分异构体
D.四种维生素E均能在稀硫酸中水解
17.将质量为m g的铁与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全。则沉淀质量为
A、5.52g B、(m+6.8)g C、(m+2.55)g D、(m+12.0)g
16.下列关于工业生产说法不正确的是
A、电解精炼铜时,用粗铜做阴极,纯铜做阳极
B、在硫酸工业、合成氨工业、硝酸工业中,皆采用循环操作提高原料利用率
C、在氯碱工业,电解槽被离子交换膜隔成阴极室和阳极室
D、在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
15.经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液离子间满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定是NH4Cl和NH3·H2O
C.若溶液离子间满足:c(Cl-)>c(NH4+)>c(OH-)>c(H+),则溶液中溶质只有NH4Cl
D.若溶液离子间满足:c(NH4+)=c(Cl-)则溶液中一定呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com