
题目列表(包括答案和解析)
1.化学与生产、生活、社会密切相关。下列有关说法中不正确的是
A.为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰。
D.氮化硅陶瓷、氧化铝陶瓷、光导纤维等属于新型无机非金属材料。
B.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物。
D.食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质。
20、(11分)现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2
 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑ ⑤Mg3N2 +6H2O
MgO+H2↑ ⑤Mg3N2 +6H2O
 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
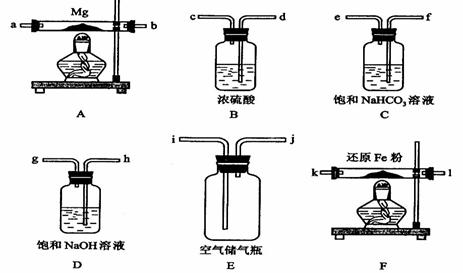
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别______________________________________;
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)__________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?__________,原因是____________________;
(4)请设计一个实验,验证产物是氮化镁:
____________________________________________________________________5u
19、(11分)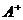 、
、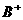 、
、 、D、E五种微粒为常见的10电子微粒,它们有如下转化关系:①
、D、E五种微粒为常见的10电子微粒,它们有如下转化关系:①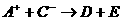 ;②
;②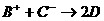 ;X、Y、Z、W为常见的18电子微粒,其中X和Z都是由单原子形成的阴离子,Y和W都是分子;又知在水溶液中X跟Y反应可生成Z和W;
;X、Y、Z、W为常见的18电子微粒,其中X和Z都是由单原子形成的阴离子,Y和W都是分子;又知在水溶液中X跟Y反应可生成Z和W;
据此,用化学语言回答下列问题:
(1)含有10个电子的阳离子为_______________,含有10个电子的阴离子为
________________。
(2)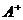 的电子式:____________;D的结构式: ____________。
的电子式:____________;D的结构式: ____________。
(3)D的浓溶液与Y的浓溶液反应时的现象为: 。
在水溶液中X跟Y反应的离子方程式是 。
18、(10分)在一定条件下,A-J等常见物质可发生如下图所示的转化。
已知:A、D、E、I、J的焰色反应均呈黄色;E为淡黄色粉末;F是黄绿色的气体单质;气体G能使带火星的木条复燃;淀粉遇H呈现出特殊的蓝色。请完成下列问题:
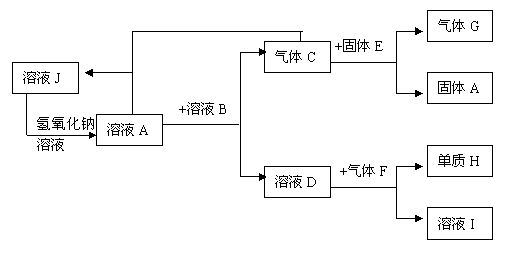

(1)分别写出固体A、溶液B中溶质的化学式:A、 , B、 ;
(2)气体C和固体E反应的化学方程式, 并用双线桥法标出电子转移的方向和数
目: ___________________________________;
(3)气体F和溶液D反应的离子方程式为:________________________________;
(4)设计实验验证I溶液中的阴离子: ;
17、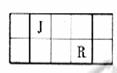 (11分) J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(11分) J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的元素。
(1)元素T在周期表中位于第_________族。
(2)J和氢组成的化合物A常用做植物生长调节剂,其电子式为________________。
(3)M和R形成的一种化合物能使酸性高锰酸钾溶液褪色,该反应的离子方程式
为___________________________________________________。
(4)写出三种仅由上述五种元素中的一种或两种元素形成的漂白剂的化学式:
______________________________________。
(5)其中L、M、R形成的氢化物沸点由高到低的顺序是______________________
(用化学式表示)
16、(6分)
(1)已知4g甲烷气体充分燃烧生成CO 2(g)和H2O(l)时,放出Q kJ的热量。写出甲烷燃烧热的热化学方程式:___________________________________。
(2)已知下列热化学方程式:
①.Fe2O3(s) + 3CO(g) = 2Fe(s) + 3CO2(g) △H= -Q1kJ/mol
②.3Fe2O3(s) + CO(g) = 2Fe3O4 (s) + CO2(g) △H= -Q2kJ/mol
③. Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H= -Q3kJ/mol
请利用盖斯定律计算:
FeO(s) + CO (g)= Fe(s) + CO2(g) 的焓变△H=____________。
15、(9分)焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4C1、FeC13、N2、Fe2O3、Fe和X。 (1)根据题意,可判断出X是 (写化学式)。 (2)写出并配平该反应的化学方程式 .
(3)发生氧化反应的物质是 ,反应中4mol的氧化剂能 (填“失去”或“得到”) mol电子.
(4)反应中被氧化产生了11.2L(标准状况)的气体时,被还原的物质的质量为 。
14、在2L的密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g) zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4 B.B的转化率是20%
C.A的平衡浓度是1.4mol/L D.平衡时气体压强是原来的
第Ⅱ卷(58分)
13、已知: (1) H2(g)+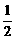 O2(g)=H2O(g) DH1=akJ/mol
O2(g)=H2O(g) DH1=akJ/mol
(2) 2H2(g)+O2(g)=2H2O(g) DH2=b kJ/mol
(3) H2(g)+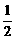 O2(g)=H2O(l) DH3=c kJ/mol
O2(g)=H2O(l) DH3=c kJ/mol
(4) 2H2(g)+O2(g)=2H2O(l) DH4=d kJ/mol
下列关系式中正确的是 ( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
12、短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且
Y2-与Z+核外电子层结构相同。下列化合物中同时存在离子键和共价键的是( )
A.ZYX B.X2Y2 C.Z2Y D.Z2Y2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com