
题目列表(包括答案和解析)
3.下列叙述正确的是 ( )
A.Cl2和SO2的漂白原理不同,混合使用效果更好
B.FeCl2和Fe(OH)3都不能通过化合反应直接制取
C.用铂丝蘸取某溶液在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰颜色为紫色,说明原溶液中不含Na+
D.常温下,向某饱和的Na2CO3溶液中通入大量的CO2气体,结果有晶体析出
2.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了处长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是 ( )
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁
C.食盐、硫酸亚铁 D.生石灰、食盐
1.下列说法正确的是 ( )
A.化合反应和置换反应均为氧化还原反应
B.二氧化硫、二氧化氮和二氧化碳均会导致酸雨
C.饮用水的生产可长期大量采用明矾作为净水剂
D.混浊的河水是溶液、浊液、胶体共存的分散系
20.(16分)某校化学研究性学习小组在学习金属知识后,探究Cu的常见化合物性质。过程如下:
[提出问题]
①在周期表中Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu0有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用药品有CuS04溶液、____、____(填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72g,A的化学式为____。向A中加入过量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)为解决问题③,设计的实验装置为:(夹持及尾浓氨:出气处理装置未画出),实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染气体。该气体的化学式为 。
[实验结论]
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
(2)根据实验方案(2),得出的+1价Cu和+2价Cu稳定性大小的结论是高温时在酸性溶液中 。
(3)CuO能够被NH3还原。
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?

19.(17分)下表是元素周期表的一部分,A、B、C、D、E、X、Y是由表中给出无素组成的常见单质或化合物。
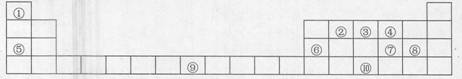
已知A、B、C、D、E、X存在如图所示的转化关系
(部分生成物和反应条件已略去)。
(1)若A、E均由元素③、④组成,则A的化学式
为_ ___,A与水反应的化学方程式__ _ _。
①当X是由元素②、④、⑤组成的碱性盐溶液时,C分子有22个电子,C分子中6键与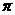 键个数之比
,表示X溶液呈碱性的第一步反应离子方程式____。
键个数之比
,表示X溶液呈碱性的第一步反应离子方程式____。
②当X为⑨单质时,写出X基态原予的核外电子排布式 X与过量B的稀溶液反应生成C的离子方程式为 。
(2)若A由元素①、⑤组成,D既能与强酸溶液反应又能与强碱溶液反应。则E的名称为__ __ ,C与X反应的离子方程式为 。
(3)若A是由元素⑥、⑦组成,写出B的电子式 ,写出B和D反应生成单质C的化学方程式 ____。
(4)Y由④、⑤、⑧三种元素组成,其水溶液是生活中常用的84消毒液的主要成分。⑩单质可与Y在碱溶液中反应,当消耗1mol还原剂时,消耗2.5mol氧化剂,转移5mol电子。该反应的离子方程式为 。
18.(16分)某强酸性的X溶液,含有Ba2+、Al3+、SiO32-、AlO2-、NH4+、Fe2+、Fe3+、
CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:

依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是 ;不能确定的是 。
对不能确定是否存在的离子,可以另取X溶液于试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是 。(填序号)
①NaOH溶液; ②酚酞试剂; ③石蕊试剂;
④pH试纸; ⑤KSCN溶液; ⑥KMnO4溶液
(2)气体F的分子式为 ,沉淀G的化学式为 ,可以观察到反应②的现象是____ 。
(3)写出步骤⑦里生成沉淀K的离子方程
(4)要使步骤③中D、H2O、O2恰好化合完全,则D、H2O、O2的物质的量之比是
____。
17.将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、,N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL NaOH溶液完全吸收,生成的NaNO2和NaNO3两种盐溶液,其中NaNO3的物质的量:为0.2 mol,则NaOH的浓度为 ( )
A.2mol/L B.1.8mol/L C.2.4 mol/L D.3.6 mol/L
第II卷(非选择题共49分)
16.下列推断符合实际的是 ( )
A.第n周期的最后一种金属元素处在第n-l族(l<n<7,n为正整数)
B.m=l和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物
C.第n周期有n种主族金属元素(l<n<7,n为正整数)
D.原子最外层电子数大于或等于3(小于8)的元素可能是过渡元素
15.某无色溶液中可能含有I-、Na+、Fe2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是 ( )
①肯定不含I-; ②肯定不含Fe2+; ③肯定含有SO32-; ④可能含有I-
A.①③ B.①②③ C.③④ D.②③④
14.除稀有气体外,目前人类已发现的非金属元素共有16种。下列对这16种非金属元素的相关判断正确的是 ( )
A.都处于元素周期表的左下角
B.单质在反应中都只能作氧化剂
C.其中碳形成的氢化物在常温下不一定是气态
D.氧化物都是酸性氧化物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com