
题目列表(包括答案和解析)
3.下列关于强、弱电解质的叙述正确的是
A.强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.SO2的水溶液能导电,所以SO2是电解质
2.化学变化不能实现的是
①一种原子变成另一种原子 ②一种离子变成另一种离子 ③一种分子变成另一种分子 ④一种单质变成另一种单质 ⑤一个质子变成一个中子 ⑥一种同素异形体变成另一种同素异形体 ⑦混合物变成纯净物 ⑧有毒有污染的物质变成无毒无污染的物质 ⑨金属变非金属
A.②③④⑥⑦ B.①②⑤ C.②⑦⑧ D.①⑤⑨
1.为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是
A.NaClO溶液的消毒原理是使蛋白质变性
B.1molCl2与足量NaOH溶液反应转移2mol电子
C.NaClO溶液的漂白原理与Na2O2、SO2相同
D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果
20.(16分)Y是由硫的含氧酸盐组成的纯净物或者混合物,该物质可溶于水,食品工业常将它用作漂白剂、防腐剂、疏松剂、护色剂及保鲜剂等。化学兴趣小组在实验室对Y中硫元素的价态进行探究:①将过量的稀硝酸加入少量样品中,振荡;②取少许反应后的溶液,滴加硝酸钡溶液,出现白色沉淀。甲认为不能由此确定Y中硫的价态为+6价。
(1)上述实验中产生的沉淀是 。
(2)你认为甲的判断是否正确 (填“是”或“否”),作出这种判断的依据是 。
(3)请完成对硫元素价态的探究:
限定实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管和试管架;1mol·L-1H2SO4、2mol·L-1 HCl、2mol·L-1HNO3、3%H2O2、0.5mol·L-1BaCl2、品红试纸、蒸馏水。
①提出合理假设
假设1,硫的价态是+4价
假设2,硫的价态是+6价
假设3,
②设计实验方案证明你的假设
③实验过程
根据②的实验方案,进行实验。请写出实验步骤、预期现象与结论。
|
实验操作 |
预期的现象与结论 |
|
操作1 |
|
|
操作2 |
|
19.(8分)在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质是行测定,测得如下数据:
|
物质 |
X |
Y |
Z |
Q |
|
反应前质量/g |
40.0 |
4.6 |
37.8 |
0.0 |
|
反应后质量/g |
43.6 |
待测数据 |
12.6 |
3.2 |
请回答下列问题:
(1)上表中“等测数据”的数值是 ,此密闭容器中化学反应类型属于 反应(填基本反应类型)。
(2)若X是水,Y是氮的氧化物,且反应式的计量系数比n(X):n(Y):n(Z):n(Q)=2:4:4:1,写出化学反应的方程式: 。
(3)反应结束后,若将反应体系内的Y物质取出,要标准状况下测得其体积小于11.2L,其原因是 。
18.(18分)铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是 ;X与过量浓硝酸反应后溶液中含有的盐的化学式为 。
(2)某溶液中有Mg2+、Fe2+、A13+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入到过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是 ;
A.Mg2+ B.Fe2+ C.A13+ D.Cu2+
(3)氧化铁是重要工业颜料,用废秩屑制备它的流程如下:

回答下列问题:
①操作I的名称是 ,操作II的名称是 ;操作III的
方法为 。
②Na2CO3溶液可以除油污,原因是(用离子方程式表示) ;
③请完成生成FeCO3沉淀的离子方程式 。
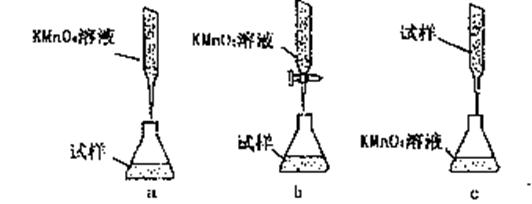
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定
(5Fe2++MnO-4+8H+====5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是 。
A.稀硝酸 B.稀盐酸 C.稀硫酸 D.浓硝酸
③某同学设计的下列滴定方式,最合理的是 。(夹持部分略去)(填字母序号)
17.(10分)2010年10月1日,我国利用“长三丙”火箭成功发射“嫦娥二号”探月卫星。
(1)火箭升高时,由于与大气层的剧烈摩擦产生高温。为了防止火箭温度过高,在火箭表面涂上一层特殊的涂料,该涂料的性质最可能是 。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
(2)火箭常用N2O4和N2H4作为燃料,请配平其反应的方程式:
N2O4+ N2H4= N2+ H2O
(3)不久我国准备发射探月飞船,为了向宇航员提供氧气,飞船上有专门的供氧装置。现提供有供氧剂Na2O2与KO2。
①写出KO2与CO2反应的化学方程式 。
②你认为最佳的供氧剂是 ,理由是 。
16.将氯化铝溶液和氢化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1:3 ②2:3 ③1:4 ④2:7 ⑤任意比
A.②③ B.只有⑤ C.②④ D.①④
第Ⅱ卷(非选择题,52分)
15.某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
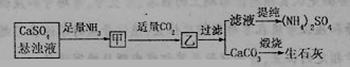
下列推断不合理的是 ( )
A.直接蒸干滤液得到纯净的(NH4)2SO4
B.生成1mol(NH4)2SO4至少2molNH3
C.CO2可被循环使用
D.往甲中通适量CO2有利于(NH4)2SO4生成
14.为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是 ( )
A.氢氧化钠是否变质(BaC12) B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.K2SO3是否被氧化(BaC12)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com