
题目列表(包括答案和解析)
23.若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小) ( )
A.2ω1=ω2 B.2ω2=ω1 C.ω2>2ω1 D.ω1<ω2<2ω1
22.将100g浓度为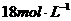 、密度为
、密度为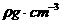 的浓硫酸加入到一定量的水中,使之稀释成
的浓硫酸加入到一定量的水中,使之稀释成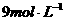 的硫酸,则需水的体积为 ( )
的硫酸,则需水的体积为 ( )
A.小于100mL B.等于100mL C.大于100mL D.等于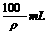
21.在标准状况下,甲乙两容器分别乘有甲烷气体和氨气。已知它们所含原子数目相同,则甲乙两容器的体积比为 ( )
A..4:3 B.5:4 C.4:5 D.1:1
20.设阿伏加德罗常数为NA,下列说法正确的是 ( )
A.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B.1molNa2O2与CO2足量反应时,转移2NA个电子
C.1mol/L的NaOH溶液中含Na+数目为NA
D.1molNa2O2晶体中含有的阴离子数目为2NA
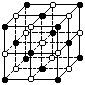
19.有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为 ( )
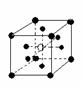
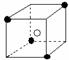
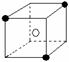
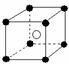
A B C D
18.纳米材料的表面微粒数占微粒总数的比例极大,这是它 有许多
特殊性质的原因,假设某氯化钠纳米颗粒的大小和 形状恰好与氯
化钠晶胞的大小和形状相同(如图所示),则 这种纳米颗粒的表
面微粒数占总微粒数的百分数为 ( )
A.33.3% B.50% C.87.5% D.96.3%
17.实验测得25℃时干冰晶体的晶胞边长为acm,其摩尔质量为Mg/mol,阿伏加德罗常数为NA,则该干冰晶体的密度为(单位:g/cm3) .
 A.
A.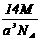 B.
B.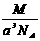 C.
C.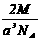 D.
D.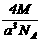
16.在食盐晶体中,已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是 ( )
A.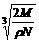 cm
B.
cm
B.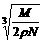 cm
cm
C.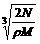 cm
D.
cm
D.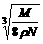 cm
cm
15.一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3--HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为 ( )
A.1:1 B.5:4 C.5:3 D.3:5
14.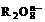 离子在一定条件下可把Mn2+氧化成
离子在一定条件下可把Mn2+氧化成 ,若反应后
,若反应后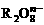 变成
变成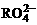 ,又知反应中氧化剂与还原剂的离子个数比为5:2,则
,又知反应中氧化剂与还原剂的离子个数比为5:2,则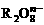 中R元素的化合价为 ( )
中R元素的化合价为 ( )
A.+3 B.+5 C.+6 D.+7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com