
题目列表(包括答案和解析)
33. (6分)二氧化硅晶体是立体的网状结构。其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(6分)二氧化硅晶体是立体的网状结构。其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为 元环。
(2)每个硅原子为 个最小环共有。
(3)每个最小环平均拥有 个氧原子。
32.(5分)下表列出了前20号元素中的某些元素性质的有关数据:
|
元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
|
原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
|
最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
|
最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是(填写编号) 。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于 ;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
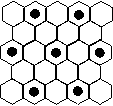
(3)元素⑤的某种单质具有平面层状结构,同一层中 的原子构成许许多多的正六边形,此单质与熔融的② 单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
31.(4分)(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_________________________________。
(2)在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:______________________________。
30.(6分)下列溶液中可能含有SO 、SO
、SO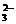 、S2-、Cl-、Br-、I-、NO
、S2-、Cl-、Br-、I-、NO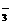 、Na+、Mg2+等离子.
、Na+、Mg2+等离子.
(1)滴入溴水后,溶液由无色变为棕黄色,并出现浑浊,则溶液中一定含有_______。
(2)若加氯化钡溶液及盐酸的混合溶液无沉淀生成.若先加入氯水,然后再加入氯化钡溶液和盐酸,有白色沉淀生成,则原溶液中一定含有_____________________。
(3)若加入氢氧化钡溶液无沉淀生成,加入硝酸银溶液也无沉淀生成,则原溶液中阴、阳离子只可能是_____________________________。
29.(4分)在酸性条件下,许多氧化剂可使KI溶液中的I-氧化,
例如KIO3(IO3-→I2)、H2O2(H2O2→H2O)、FeCl3(Fe3+→Fe2+)、K2Cr2O7(Cr2O72-→Cr3+)。请根据题目要求填空:
(1)写出在醋酸存在的条件下KIO3溶液与KI溶液反应的离子方程式
;
(2)在酸性条件下(足量),各取1 L浓度为1 mol·L-1的KI溶液分别与上述列举四种溶液进行完全反应,则需要溶质的物质的量之比为n(KIO3):n(H2O2):n(FeCl3):n(K2Cr2O7)= : : : .
28.(6分)已知氨气跟氯气可迅速反应生成氯化铵和氮气。当转移的电子总数为a个时,生成的氮气的物质的量bmol.
(1)写出该反应的化学方程式:
(2)该反应中参加氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)阿伏加德罗数常数为(用含a、b的代数式表示) 。
27.(4分)
(1)用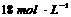 的硫酸配制
的硫酸配制 硫酸,若实验仪器有:
硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号)_________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)___________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm-3cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近容量瓶刻度标线1cm-2cm处,用滴管滴加蒸馏水到刻度线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
26.某结晶水合物的化学式为R·xH2O其相对分子质量为Mr,在25℃时a g晶体溶于b g水中,恰好达饱和,形成V mL溶液,则下列表达式中不正确的是 ( )
A.饱和溶液的物质的量浓度100a(Mr-18x)/MrV
B.饱和溶液的质量分数a(Mr-18x)/(a+b)Mr
C.25℃,R的溶解度100a(Mr-18x)/(bMr+18ax)
D.饱和溶液的密度(a+b)/V
25.设阿伏加德罗常数为NA,下列说法正确的是 ( )
A.0.1mol乙醇中含有C-H键的数目为0.6NA
B.12g金刚石含有碳碳键数为4NA
C.常温常压下,0.2mol的SiO2所含分子数为0.2NA
D.31g白磷(P4)中含有(3/2)NA个P-P键
24.一定量的某溶液,其质量分数为0.2 a , 当加入水稀释后, 其质量分数为0.1 a 。则原溶液的密度 ( )
A.大于水的密度 B.等于水的密度
C.小于水的密度 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com