
题目列表(包括答案和解析)
26.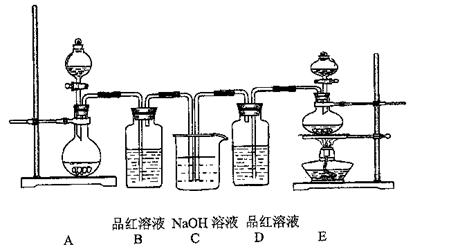 某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置:
(1)实验室常用装置E制各Cl2,指出该反应中浓盐酸所表现出的性质
(2)反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,给B、D两个容器加热,两个容器中的现象分别为:B D
(3)装置C的作用是
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
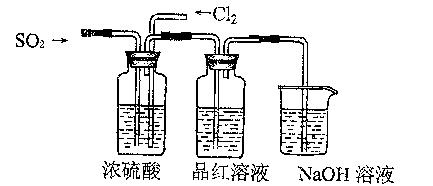
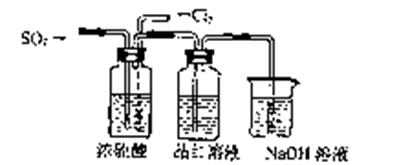
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是
品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(文字结合离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
25.某反应体系中的物质有:NaOH、AU2O3、Na2S4O6、Na2S2O3、Au2O、H2O。已知:Au2O3在所给物质中氧化性最强。
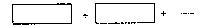
(1)请将反应物与生成物分别填入以下空格内:

(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
(4)坊织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HC1,则还原剂与氧化剂物质的量之比为
。
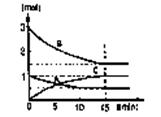
24.(1)在某容积不变的密闭容器中,有可逆反应:
 mA(g)+nB(g)
pC(g)+qD(S)+Q(Q>0)如图某反应过程中各物质物质的
mA(g)+nB(g)
pC(g)+qD(S)+Q(Q>0)如图某反应过程中各物质物质的
量n(mol)随时间t(nub)的变化曲线图。
 达到化学平衡
达到化学平衡
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示):
。
②若充入A,K值 (填一定增大、一定减小、或可能增大
也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件
下,根据图示回答下列问题:在0-15min内的平均反应速率:v(B)=
 (2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。
(2)对于某可逆反应:A(g)+B(g) 2C(g)+Q(Q>0)。
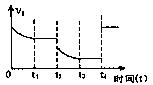 若该反应的正反应速率与时间的关系如图所示。在其它条件
若该反应的正反应速率与时间的关系如图所示。在其它条件
不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
23.元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题:
|
A |
单质是热和电的良导体,熔点97.81℃,沸点882.9°C,在氧气中燃烧得到淡黄色固体。 |
|
B |
原子核外有7种运动状态不同的电子 |
|
C |
单质常温、常压下是气俸,原子的L层有一个未成对的p电子。 |
|
D |
+2价阳离子的核外电子排布与氖原子相同。 |
(1)B元素原子的最外层轨道表示式是 ,D离子的核外电子排布 式是 。C和D形成的化合物的电子式为 。
(2)A、B、C、D的原子半径大小为: > > >(用元素符号表示)
(3)D单质在B单质中燃烧的化学方程式为
(4)A和D两元素金属性较强的是(用元素符号表示)____。写出能证明该结论的一个实验事实
22.12在KI溶液中存在下列平衡:
 I2(aq)+I-(aq) I-3(aq)
I2(aq)+I-(aq) I-3(aq)
某I2、、KI混合溶液中,I-3的物质的量浓度c(i-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
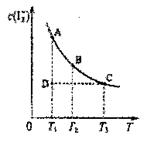
 A.反应I2(aq)+I-(aq)
I-3(aq)的Q<0
A.反应I2(aq)+I-(aq)
I-3(aq)的Q<0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
第Ⅱ卷
填写在答题纸上,注意试题题号和答题纸上的编号一一对应,不能错位。答案写在试卷上一
律不给分。
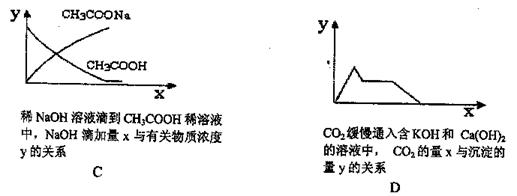
21.下列坐标图所表示的量的关系正确的是 ( )

20.下列溶液中各微粒的浓度关系不正确的是 ( )
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)=c(H+)·c(OH-)
B.1L0.1mol·L-lCuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO2-4)>c(NH+4)>c(Cu2+)>c(H+)>c(OH-)
C.0.l mol.L-1NaHCO3溶液中:
c(Na+)+c(H+)+c(H2CO3)=c(HCO-3)+c(CO2-3)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
19.下列离子方程式的书写正确的是 ( )
A.弱酸尼泊金酸(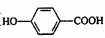 )与足量的碳酸氢钠溶液反应
)与足量的碳酸氢钠溶液反应
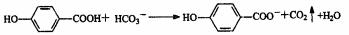
B.将0.0lmol氯气遥入10mL 1mol/L的FeB12消液中
2Fe2++2Br一+3C12→2Fe3++6Cl-+Br2
C.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液
Ca2++HCO-3+OH-→CaCO3↓+H2O
D.向Ba(OH)2溶液中逐滴加入KHSO4溶液至Ba2+刚好沉淀完全
Ba2++OH-+H++ SO2-4→BaSO4↓+H2O
18.下列叙述正确的是 ( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CC14是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子处在2个O原予所连成的直线的中央
17.amol FeS与bmol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④ mol
mol
A.①④ B.②③ C.①③ D.②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com