
题目列表(包括答案和解析)
5.下列物质的保存方法正确的是( )
①少量金属钠保存在冷水中 ②浓硝酸盛放在无色试剂瓶中
③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡胶塞的细口瓶中
⑦氢氟酸保存在塑料瓶中 ⑧碘易升华,保存在盛有水的棕色试剂瓶中
A.②③④⑤ B.③④⑦⑧ C.③④⑦ D.①③④⑦
4.下列能够检验出KI中是否含有Br一的实验是( )
A.加入足量的新制氯水,溶液变色则有Br-
B.加入酸性KMn04溶液,观察溶液颜色是否褪去
C.加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br一
3.下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
2.下列有关物质用途的说法中,正确的是( )
A.二氧化硅可用来制造半导体材料 B.硝酸常用作金属铜加工前的酸洗
C.氢氧化钠可用于治疗胃酸过多 D.三氧化二铁常用作红色油漆和涂料
1.符合实际并用于工业生产的是( )
A.CO2通入氢氧化钠溶液中制Na2CO3 B.H2和Cl2光照制HCl
C.Cl2通入澄清石灰水中制漂粉精 D.用硫磺制硫酸
31.(10分)粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4%,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+3Na2CO3→2NaAlSiO4+4NaAlO2+3CO2 ↑ ①
Al6Si2O13+5Na2CO3→2Na2SiO3+6NaAlO2+5CO2 ↑ ②
SiO2+Na2CO3→Na2SiO3+CO2 ↑ ③
(1)粉煤灰中铝的质量分数为 %。
(2)用l mol Al6Si2O13和4mol SiO2制得5mol NaAlO2、lmolNaAlSiO4,还应制得Na2SiO3 mol,共消耗Na2CO3 mol(得到的固体中无SiO2)。
(3)若粉煤灰中Al6Si2O13与SiO2的物质的量之比为1:2,则1妇粉煤灰与6molNa2CO3反应(反应物全部都参与反应),可制得NaAlO2 mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2)=x,消耗Na2CO3 ymol,试确定y与x的关系式。
30.(6分)白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、si、H的氧化物表示、。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为 g/mol。
(2)另取4.05g白玉粉末加入lmol/L的盐酸100mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则①p= ;②白玉的化学式为 。
29.2005年的诺贝尔化学奖颁给在烯烃复分解反应研究方面做出突出贡献的化学家。烯烃复分解是指在催化条件下实现C=C双键断裂两边基团换位的反应。
如图表示两个丙烯分子进行烯烃复分解,生成两个新的烯烃分子:2一丁烯和乙烯。

现以丙烯为原料,可以分别合成重要的化工原料I和G,I和G在不同条件下反应可生成多种化工产品,如环酯J;
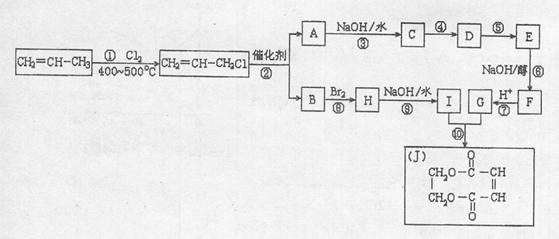
(1)反应①的类型: 反应;反应⑥的类型: 反应
(2)G的结构简式: ;反应⑩的反应条件:
(3)反应②的化学方程式是 ;
(4)反应④中C与HCl气体在一定条件只发生加成反应,反应④和⑤不能调换的原因是 ,E的结构简式: ;
(5)反应⑨的化学方程式: 。
28.化学式为C8H10O的化合物A具有如下性质:
①A+Na→慢慢产生气泡
②A十RCOO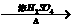 有香味的产物
有香味的产物
③A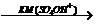 苯甲酸
苯甲酸
④其催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应中可制得一种塑料制品(它是目前主要的“白色污染”源之一。)
试回答:
(1)根据上述信息,对该化合物的结构可作出的判断是 (多选扣分)
A.苯环上直接连有羟基
B.肯定有醇羟基
C.苯环侧链末端有甲基
D.肯定是芳香烃
(2)化合物A的结构简式 。
(3)A和金属钠反应的化学方程式 。
(4)A的脱水反应化学方程式 。
27.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
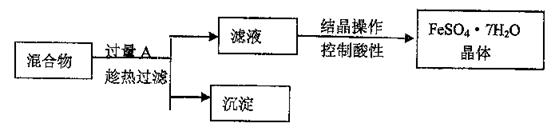
请根据题目要求回答下列问题:
(1)A的化学式为 ,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤ 。
(2)趁热过滤的目的是 。
(3)结晶操作过程中应控制滤液酸性的原因是____
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____ 。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。

①该装置中最不合理的部分 (填字母),原因是 。
②改用正确装置实验开始后,B处变蓝,说明草酸亚铁晶体中有 ;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com