
题目列表(包括答案和解析)
17.(10分)已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答以下问题:
H++A2-。回答以下问题:
(1)NaHA溶液 (填“显酸性”、 “显碱性”、 “显中性”或“酸碱性无法确定”)。
(2)某温度下,若向0.1 mol/L的NaHA溶液中滴入0.1 mol/L KOH溶液使混合溶液中c(H+)=c(OH-),则此时该混合溶液中下列关系中一定正确的是 (填字母)。
A.c(H+)·c(OH-)=1×10―14 mol2·L―2
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下一空格同样)。
②滴加少量浓盐酸,c(Ca2+)_ 。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式 。
16.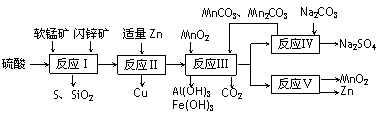 (10分)某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
(10分)某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
(1)装置Ⅰ中发生了多个氧化还原反应,写出其中由CuS转化为CuSO4的化学反应方程式: 。
(2)反应Ⅱ若加入锌过量,会进一步发生反应的离子方程式为 ,反应Ⅲ中加入MnO2的目的为 。
(3)已知Ksp(MnCO3)=1.8×10-11、Ksp(ZnCO3)=1.4×10-11,装置Ⅳ中充分反应后溶液中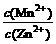 = 。
= 。
(4)装置Ⅴ中发生的反应是用惰性电极对反应Ⅲ所得溶液进行电解,则阳极发生的电极反应可表示为 。
15.(10分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料(见光易分解),实验室可用如下方法来制备这种材料并测定它的组成。
Ⅰ.制备
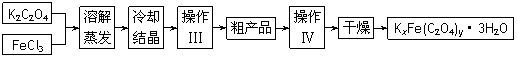

(1)冷却结晶时应注意:①将溶液用冰水冷却;② 。
(2)操作Ⅲ所需的主要玻璃仪器有 ,操作Ⅳ的名称是 。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,又用去KMnO4溶液4.00mL。相关反应的化学方程式如下:2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(3)滴定时应选用 滴定管,两次滴定中,滴定终点的现象是 。
(4)该化合物KxFe(C2O4)y·3H2O中,x= 。
14.在1 L的密闭容器中充入1
molA(g)和1 mol B(g),于T℃时进行如下反应:A(g)+B(g) C(g)+D(g) △H<0达到平衡时,A转化了50%。在T℃时,将1
molA(g)和4 molB(g)充入同样的容器中,记录0-8
min内容器中各物质的
C(g)+D(g) △H<0达到平衡时,A转化了50%。在T℃时,将1
molA(g)和4 molB(g)充入同样的容器中,记录0-8
min内容器中各物质的
量如右表。t min时为改变条件后达平衡时所测得的数据。下列说法正确的是( )
|
时间/min |
0 |
4 |
6 |
8 |
t |
|
n[A(g)]/mol |
l |
0.25 |
nl |
nl |
0.15 |
|
n[B(g)]/mol |
4 |
3.25 |
n2 |
n2 |
3.15 |
|
n[C(g)]/mol |
0 |
0.75 |
n3 |
n3 |
0.85 |
|
n[D(g)]/mol |
0 |
0.75 |
n4 |
n4 |
0.85 |
A.反应在第4 min时处于化学平衡状态
B.前4 min,用A(g)表示的化学反应速率为0.0625 mol·L-1·min-1
C.8 min时,混合气体中C(g)的体积分数为16%
D.t min时,反应所处的温度低于T℃
非选择题
13.25℃时,几种弱酸的电离常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2S |
|
电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=
1.3×10-7、K2=
7.1×10-15 |
25℃时,下列说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.HCN与NaOH两溶液等体积混合后若c(Na+)> c(CN-),则一定是前者的较浓
C.NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
12.X、Y、Z、W都是短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X、Y、Z三种原子的最外层电子数之和为19。下列说法正确的是 ( )
A.Y元素最高价氧化物对应水化物的化学式为:HYO4
B.X、Y、Z形成的简单离子的半径大小为:Yn->Zm->Xm-
C.元素Z、Y分别与元素W形成的化合物的热稳定性为:WmZ<WnY
D.相同条件下,HnY溶液的酸性比HmZ溶液的酸性弱
11.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+7种离子中的几种。取该溶液进行实验时现象如下:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断该溶液中肯定不存在的离子组是 ( )
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
10.下图Ⅰ、Ⅱ分别是甲、乙两同学将反应“AsO43-+2I-+2H+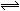 AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。下列叙述中正确的是 ( )
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。甲向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙向图ⅡB烧杯中逐滴加入适量40%NaOH溶液。下列叙述中正确的是 ( )

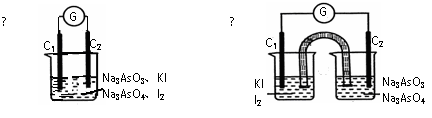
|
|
A.甲操作时,溶液颜色变浅
B.甲操作时,微安表(G)指针发生偏转
C.乙操作时,C2做正极
D.乙操作时,C1上发生的电极反应为I2+2e-=2I-
9.下列实验过程中,通常不需要使用玻璃棒的是 ( )
①用pH试纸测定Na 2CO3溶液的pH;②用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液;③从氯酸钾和二氧化锰制取氧气的剩余物中提取KCl;④用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2;⑤探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化;⑥用适量的蔗糖和浓硫酸等探究浓硫酸的脱水性。
A.①③⑤⑥ B.②④ C.②③④ D.②④⑥
8.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O。用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是 ( )
A.上述反应中,b∶c为一常数
B.由反应可确定氧化性:HClO4>HClO
C.若化学计量数a=8,b=3,则该反应转移电子数为20e-
D.变蓝的淀粉碘化钾试纸褪色是因为发生了5C12+I2+6H2O=12H++10Cl-+2IO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com