
题目列表(包括答案和解析)
16.向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是 ( )
 A.线段Ⅲ代表Fe2+的变化情况
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a数值等于6
D.原混合溶液中n(FeBr2)=4 mol
15.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、
Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
①K+一定存在; ②100mL溶液中含0.01mol CO32-;
③ Cl- 可能存在; ④Ba2+一定不存在; ⑤Mg2+可能存在。
A.①② B. ③④⑤ C.①③④ D.①⑤
14.a mol FeS与b mol FeO投入到V L.c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3.H2SO4的混合液,则反应中未被还原的硝酸可能为 ( )
①(a+b)×63g
②(a+b)×189 g
③(a+b)mol ④(Vc- )mol
)mol
A.①④ B.②③ C.①③ D.②④
13.有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是 ( )
A.还原产物为NH4+
B.若有1molNO3-参加还原反应,则转移8mole-
C.若把该反应设计为原电池,则负极反应为:Fe2+-e-=Fe3+
D.氧化剂与还原剂的物质的量之比为8∶1
12.有a、b、c、d、e五种气体,进行下列实验:
|
实验步骤 |
实验现象 |
|
(1)a和b混合 |
气体变红棕色 |
|
(2)c和d混合 |
产生白烟 |
|
(3)c和e分别通入少量溴水中 |
溴水都变成无色透明的液体 |
|
(4)b和e分别通氢硫酸中 |
都产生淡黄色浑浊 |
a、b、c、d、e依次可能是 ( )
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO3
C.NO、O2、NH3、HCl、SO2 D.HCl、CO2、NH3、H2S、CH4
11.稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A. 、
、 、
、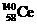 、
、 它们互称为同素异形体
它们互称为同素异形体
B.工业上可以采用电解氯化铈水溶液来获得铈单质
C.铈溶于氢碘酸的主要化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑
D.工业上金属铈一般保存在敞口容器中
10.某溶液中含有NH4+.Mg2+.Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 ( )
A.只有NH4+ B.只有 Al3+
C.NH4+和 Al3+ D.Fe2+和NH4+
9.下列实验现象与结论相符合的是 ( )
A.直接观察焰色反应火焰为浅紫色,则一定不含Na元素
B.铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色;铝热剂中一定不含Fe2O3
C.溶液中滴加盐酸酸化BaCl2溶液出现白色沉淀,则溶液中一定存在SO42-
D.某气体能使品红溶液褪色,则该气体为SO2气体
8.若以μ表示氧气的摩尔质量,v表示在标准状况下氧气的摩尔体积,ρ为在标准状况下氧气的密度,NA为阿伏加德罗常数,m.Δ分别表示每个氧分子的质量和体积,下面是四个关系式:
①NA= ②ρ= ③m= ④Δ=其中正确的是 ( )
A.①② B.①③ C.③④ D.①④
7.设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,
不能达到预期目的的是 ( )
A.分别向等量的白色粉末中加等体积.等浓度的稀盐酸,
比较生成气体的快慢
B.分别向等量的白色粉末中加等体积适量的水,比较
固体溶解量的多少
C.分别将等量的白色粉末配成溶液,然后加入澄清石灰水,比较是否有沉淀生成
D.分别将等量的白色粉末用右图装置进行实验,比较澄清石灰水是否变混浊
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com