
题目列表(包括答案和解析)
5.下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A.只有①③ B.只有②④ C.只有①②③④ D.①②③④⑤
4.下列物质中,长期置于空气中会发生颜色变化的是
①绿矾 ②氢氧化亚铁 ③氯水 ④硫酸铜 ⑤亚硫酸钠 ⑥过氧化钠
A.全部 B.只有①②③ C.①②③④⑥ D.②③④⑤⑥
3.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.①④ C.③④ D.②④
2.下列各组物质中,前者是纯净物,后者是混合物的是
A.硫酸铜晶体、铝热剂 B.水煤气、氢氧化铁胶体
C.盐酸、磷酸钙 D.玻璃、含Fe为70%的氧化铁
1.化学与生活、社会密切相关。下列说法不正确的是
A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、 保护环境
保护环境
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
D.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
21.(8分)实验室制取氯气,将多余的氯气用100 ml 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知其pH等于13 (不考虑反应前后溶液的体积变化) ,ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为 mol。
(2)被氧化的氯气的物质的量为 mol,被还原的氯气的物质的量为 mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备与尾气中等量的氯气所消耗的二氧化锰的质量为 g。
20.(12分)短周期元素X.Y.Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1︰1的离子化合物A,X与Z能形成原子个数比为1︰1的共价化合物B,它们之间能实现如下图所示转化(部分产物已略去):
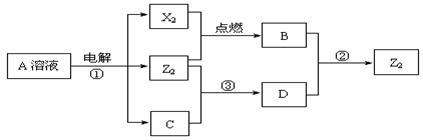
(1)Z在周期表的位置是_ ;Y单质在空气中燃烧所得产物的电子式是 。
(2)反应①的离子方程式是 。
(3)D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净.干燥的Z2,仪器装置如下图所示(夹持固定装置的仪器已略去)。
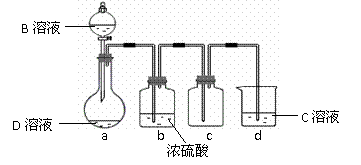

I.写出反应②的离子方程式_ 。
II.上述实验装置不够完善,改进方法是 。
Ⅲ.足量Z2 通入FeBr2溶液中发生反应的离子方程式是 。
19.(14分)现有五种可溶性物质A、B、C、D、E,它们所含的阴.阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO3- 、CO32-、X中的一种。
(1)某同学通过比较分析,认为无须检验就可判断其中必有的两种物质是 和 。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时也产生沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解。则:
①X为 (填字母)。
A.Br- B.SO C.CH3COO- D.HCO
②A中含有的阴阳离子个数之比
③利用上述已经确定的物质,可以检验出D.E中的阳离子。请简述实验操作步骤.现象及结论: 。
(3)将19.2gCu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则物质D一定含有上述离子中的 (填相应的离子符号),有关反应的离子方程式为 ,若要将Cu完全溶解,至少应加入H2SO4的物质的量是 。
18.(10分)近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
⑴汽车内燃机工作时引起反应:N2(g)+O2(g)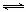 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K= 。(计算结果保留小数点后两位数字)
⑵一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如下图所示。(已知:T1<T2)
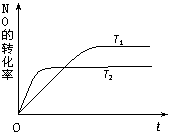

①反应 2NO(g)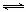 N2(g)+O2(g)为 (填“吸热”或“放热”)反应。
N2(g)+O2(g)为 (填“吸热”或“放热”)反应。
②一定温度下,能够说明反应 2NO(g)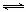 N2(g)+O2(g) 已达到平衡的是(填序号)
。
N2(g)+O2(g) 已达到平衡的是(填序号)
。
A.容器内的压强不发生变化
B.NO分解的速率和NO生成的速率相等
C.NO、N2、O2的浓度保持不变
D.单位时间内分解4 mol NO,同时生成2 mol N2
⑶①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867 kJ·mol-1
△H2= 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,该反应的化学方程式为 。
17.(8分)已知:A、B为常见的非金属单质且均为气体;甲、乙为金属单质,乙在I的浓溶液中发生钝化;C、H、J的溶液均呈碱性.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):
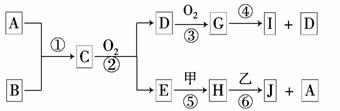
(1)写出反应② 的化学方程式为 。
(2)反应④ 中每消耗1 mol G,转移电子的物质的量为 。
(3)反应⑥ 的离子方程式是 。
(4)实验室中保存I的方法是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com