
题目列表(包括答案和解析)
25.若氢气还原氧化铜的反应进行得不完全,便得到 Cu、Cu2O、CuO的固体混合物。某化学兴趣小组同学为测定上述固体的组成进行如下操作: 取一定质量的均匀固体混合物A,将其分成两等分,取其中一份用足量氢气还原,测得反应后的固体质量减少3.20 g ,另一份加入500 mL的稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体2.24 L 。
请根据以上操作计算:
(1)A中,n(Cu) + n(Cu2O) = _______ mol;
(2)A中,n(CuO)的取值范围是______________;
(3)所用硝酸的物质的量浓度为____________ mol/L。
蚌埠二中2011届高三年级第三次质检
24.实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)= Na2SO4+SO2↑+H2O。
请用下列装置设计一个实验,将SO2转化为SO3:
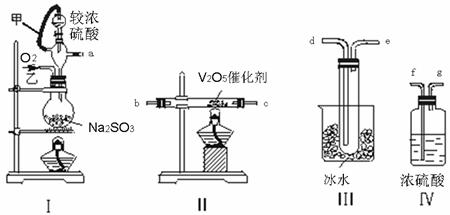
(1)这些装置的连接顺序(按气体左右的方向)是a→ → → →
→ → (填各接口的编号)。
(2)以上实验装置存在的明显缺陷是缺少尾气吸收装置,请在方框内画出此装置,并标出所用试剂(自选)的名称:

(3)实验时甲的作用是 。
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。若在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(5)Ⅲ处观察到的现象是 。
23.(1)在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为 ,反应的离子方程式是 。
(2)在碘和淀粉形成的蓝色溶液中通入SO2气体,发现蓝色逐渐消失,反应的离子方程式是 。
(3)对比①和②实验所得的结果,将I2、ClO-、SO42-按氧化性由强到弱顺序排列为 。
22.A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:

(1)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是_________________;将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是____________________。
(2)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是___________________;符合条件的D物质可能是_____________(填序号)
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
21.下列物质中,属于强电解质的是_______________(填序号,下同),属于弱电解质的是_______________,属于非电解质的是_______________。
①NH4Cl ②CaCO3 ③SO2 ④蔗糖 ⑤NaCl溶液
⑥NaHCO3 ⑦NH3·H2O ⑧液氯 ⑨铜
20.a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的有
A.HCHO B.CH3COOCH2CH3 C.HOOCCOOH D.HCOOH
第Ⅱ卷(非选择题 共40分)
19.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
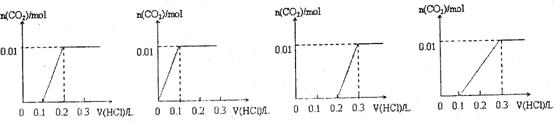
A B C D
18.在含2 mol H2SO4的浓H2SO4溶液中加入足量的Zn粉,使其充分反应,则下列推断中错误的是
①放出的气体中除SO2外还有H2;
②反应结束时转移电子的总物质的量为4 mol;
③只放出SO2气体,其物质的量为1 mol;
④反应结束后加入KNO3固体,Zn粉继续溶解。
A.① B.② C.③④ D.②③④
17.标准状况下,在三个大小相同干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4∶1 ),然后分别以水作溶剂做喷泉实验。实验结束后三个烧瓶中所得溶液的物质的量浓度之比为
A.2∶1∶2 B.5∶5∶4 C.1∶1∶1 D.无法确定
16.物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是

 A.1∶4
B.1∶5
C.2∶3
D.2∶5
A.1∶4
B.1∶5
C.2∶3
D.2∶5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com