
题目列表(包括答案和解析)
1.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料。下列说法不正确的是
A.钯催化剂能提高碳原子反应的活性
B.钯催化剂能催化所有类型的有机反应
C.“钯催化交叉偶联反应”有利于人类合成复杂分子
D.利用该技术能改变合成路径,降低反应发生的条件
29. (11分) 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(11分) 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)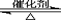 2SO3(g)
2SO3(g)
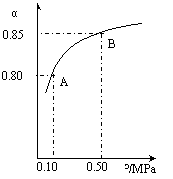
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图 所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于_____ 。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
若用标准状况下4.48L CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示)。放出的热量为______ kJ。
(3)新型纳米材料氧缺位铁酸盐
(MFe2Ox 3<x<4,M为Mn、Co、Zn或Ni),是由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
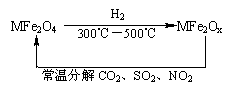
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
 (2)Fe(OH)3 Al(OH)3
(2)Fe(OH)3 Al(OH)3
(3)Cu2+ Zn2+
(4)MnO2+H2O+e-=MnOOH+OH-
(5)锌、二氧化锰

28. (13分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g) =
CH4(g)+HC
 CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH(g)+H2(g) △H1=156.6 kJ·mol-1
CH3CH
 CH2(g) =
CH4(g)+HC
CH2(g) =
CH4(g)+HC
 CH(g ) △H2=32.4
kJ·mol-1
CH(g ) △H2=32.4
kJ·mol-1
则相同条件下,丙烷分解得到丙烯和氢气的热化学方程式为
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;
放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)
(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
27.(10分) 二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
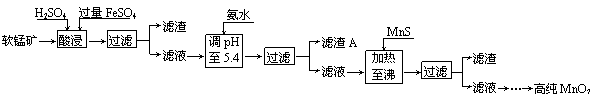
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中总反应式:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2
MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。
26、(10分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
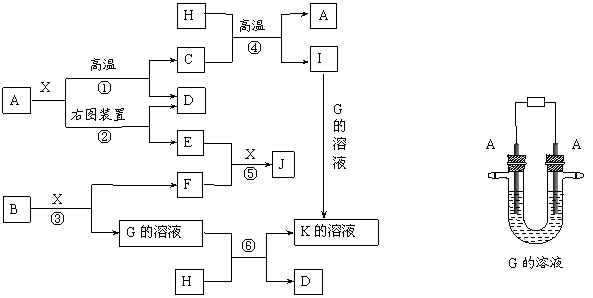
请按要求填空:
⑴写出B的化学式: 。
⑵写出用A作电极电解G溶液,在电极上生成E的反应式: ,反应⑤的现象是 。
⑶反应①的化学方程式是 ,
反应④在生产中有重要应用,被称为 反应。
⑷反应⑥的离子方程式是 。
24. 用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为 ( )
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
第II卷(共52分).5.(8分)现有a·盐酸 b·硫酸 c·醋酸三种酸:(以下均用酸的序号填写)。
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产生CO2的体积由大到小的顺序是_________________。
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。
(3)物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________
23. 用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1 盐酸,如达到滴定终点时不慎多加了1 滴NaOH溶液(1滴溶液的体积约为0.05 mL),继续加水至50 mL,所得溶液的pH是( )
A. 4 B. 7.2 C. 10 D.11.3
22. 在容积固定为2L密闭容器中,充入X、Y各2mol发生可逆反应:X(g)+2Y(g) 2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率
2Z(g)达到平衡,以Y的浓度改变表示的化学反应速率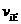 、
、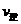 与时间的关系如下图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
与时间的关系如下图,则Y的平衡浓度的表达式正确的是(式中S指对应区域的面积)( )
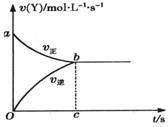
A.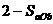 B.
B.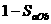 C.
C.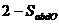 D.
D.
21.下列说法中,不正确的是 ( )[
A. 用惰性电极电解CuSO4溶液(足量)过程中,溶液的颜色逐渐变浅,pH逐渐减小
B. 在正常情况下,人体血液的pH应保持弱碱性范围,为了维持人体细胞内的酸碱平衡,人需要选择不同的酸性食物或碱性食物来加以控制。
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
20. 某温度下,重水(D2O)的离子积常数为1.6×10-15 若用定义pH一样来规定
pD=-lg(D+ ),则在该温度下,下列叙述正确的是( )。
A 纯净的重水中,pD=7 B 1 L溶解有0.01 mol DC1的重水溶液,其pD=2
C 1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
D 纯净的重水中, C(D+ )C(OD- )>1.0×10-1 4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com