
题目列表(包括答案和解析)
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。
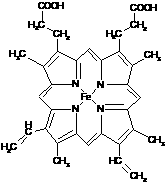
血红素的结构式
回答下列问题:
 ⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ▲ ,写出基态Fe原子的核外电子排布式 ▲
。
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是 ▲ ,写出基态Fe原子的核外电子排布式 ▲
。
⑵血红素中N原子的杂化方式为 ▲ ,在右图的方框内用“→”标出Fe2+的配位键。
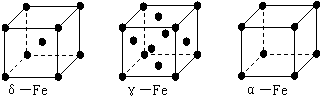
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 ▲ ,δ、α两种晶胞中铁原子的配位数之比为 ▲ 。
B.我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量。通常把1升水中含有10mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测,实验过程如下:
实验中涉及的部分反应:M2+(金属离子)+EBT(铬黑T) =M EBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA) = MY2-
MEBT+Y4-(EDTA) = MY2-+EBT(铬黑T)
⑴取地下水样品25.0毫升进行预处理。已知水中由Ca2+、Mg2+和HCO3-所引起的硬度称为暂时硬度,可通过加热减小硬度,写出加热时所发生的化学反应(任写一个) ▲ 。预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 ▲ 。
⑵将处理后的水样转移到250 mL的锥形瓶中,加入氨水-氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.0100 mol·L-1的EDTA标准溶液进行滴定,滴定时眼睛应 ▲ ,滴定终点时的实验现象是 ▲ 。
⑶滴定终点时共消耗EDTA溶液15.0 mL,则该地下水的硬度= ▲ 。
⑷若实验时装有EDTA标准液的滴定管只用蒸馏水润洗而未用标准液润洗,则测定结果将 ▲ (填“偏大”、“偏小”或“无影响”)。
20.(10分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O2(g) = CO2(g) △H1=-393.5 kJ·mol-1 ①
C(s)+CO2(g) = 2CO(g) △H2=+172.5 kJ·mol-1 ②
4CO(g)+Fe3O4(s) = 4CO2(g)+3Fe(s) △H3=-13.7 kJ·mol-1 ③
请回答下列问题:
⑴计算3Fe(s)+2O2(g) = Fe3O4(s)的△H= ▲ 。
⑵800℃时,C(s)+CO2(g) 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向 ▲ (填“正”或“逆”)方向进行。
⑶某种矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜
粉充分反应后过滤、洗涤、干燥得剩余固体3.6 g。剩下滤液用浓度为2 mol·L-1的酸性KMnO4滴定,至终点时消耗KMnO4溶液体积25.0 mL。
提示:2Fe3++Cu=2Fe2++Cu2+ 8H++MnO4-+5Fe2+=Mn2++5Fe3++4H2O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物FemOn的化学式(m、n为正整数)
19.
(14分) X( )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下:


已知:
请回答下列问题:
⑴由单体X合成所得高分子粘合剂的结构简式是 ▲ 。
⑵物质C中所含官能团的名称是 ▲ 。
⑶写出由A→B的反应方程式: ▲ 。
⑷C→D、D→E的反应顺序能否颠倒并说明理由 ▲ 。
⑸C→D、A+F→G的反应类型依次为 ▲ 、 ▲ 反应。
⑹F的同分异构体中,属于酯类且含有“-C≡C-”结构,除了CH3COOC≡CH、 HCOOC≡CCH3外,还有的结构简式为 ▲ 、 ▲ 。
18.(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
|
难溶物 |
Ksp |
|
Ca3(AsO4)2 |
6.8×10-19 |
|
AlAsO4 |
1.6×10-16 |
|
FeAsO4 |
5.7×10-21 |
|
污染物 |
H2SO4 |
As |
|
浓度 |
28.42 g/L |
1.6 g·L-1 |
|
排放标准 |
pH 6-9 |
0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ▲ mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ▲ ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ▲ mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 ▲ 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ▲ ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 ▲ 。
17.(8分)尿素(H2NCONH2)是一种非常重要的高氮化肥,工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2
(l) △H=-103.7 kJ·mol-1
试回答下列问题:
⑴下列措施中有利于提高尿素的产率的是___________。
A.采用高温 B.采用高压 C.寻找更高效的催化剂
⑵合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵) (l) △H1
H2NCOONH4(氨基甲酸铵) (l) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)
△H2
H2O(l)+H2NCONH2(l)
△H2



 某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
图Ⅰ 图Ⅱ
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 ▲ 步反应决定,总反应进行到 ▲ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)= ▲ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ▲ 0(填“>”“<”或“=”)
16.(10分)我国是氧化铝生产大国,工业上每生产1 t氧化铝将排出1-2 t赤泥,赤泥大量堆积会对环境造成严重污染。赤泥中主要成分及含量:CaO约占46%、SiO2约占22%、Al2O3约占7%、Fe2O3约占11%、TiO2约占5%及少量其他物质。
⑴一种利用废弃赤泥的方法是将赤泥配成一定的液固比,作为一种吸收剂,吸收热电厂排放的含SO2的烟气,写出吸收SO2时可能发生的化学反应方程式 ▲ 。
⑵为综合利用赤泥中的各种成分,某科研小组设计了如下工艺流程:

已知:TiO2不溶于稀盐酸、稀硫酸,能溶于浓硫酸生成TiOSO4(硫酸氧钛,易水解)。
①氧化物D的化学式是 ▲ ,原料A最好是下列物质中的 ▲ 。
A.氨水 B.氢氧化钠 C.生石灰 D.双氧水
②写出上述工艺中投入氢氧化钠时反应的离子方程式 ▲ 。
③写出上述工艺中稀释时发生水解反应的化学方程式 ▲ 。
15.(12分)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于醇、醚,熔点5.5 ℃,沸点267.4 ℃。1-乙氧基萘常用作香料,也可作为合成其他香料的原料。实验室制备1-乙氧基萘的过程如下:
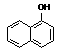 +C2H5OH
+C2H5OH

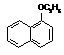 +H2O
+H2O
1-萘酚 1-乙氧基萘
⑴将72 g 1-萘酚溶于100 mL无水乙醇中,加入5 mL浓硫酸混合。将混合液置于如图所示的容器中加热充分反应。实验中使用过量乙醇的原因是 ▲ 。烧瓶上连接长直玻璃管的主要作用是 ▲ 。
⑵反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作: ①蒸馏 ②水洗并分液 ③用10%的NaOH溶液碱洗并分液 ④用无水氯化钙干燥并过滤。正确的顺序是 ▲ 。
A.③②④① B.①②③④ C.②①③④
 ⑶蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 ▲ 。
⑶蒸馏时所用的玻璃仪器除了酒精灯、冷凝管、接收器、锥形瓶外还有 ▲ 。
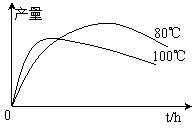
⑷实验测得1-乙氧基萘的产量与反应时间、温度的变化如图所示,时间延长、温度升高1-乙氧基萘的产量下降的原因可能是 ▲ 、 ▲ 。
⑸用金属钠可检验1-乙氧基萘是否纯净,简述实验现象与结论: ▲ 。
14.向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A.充入2 mol SO3后,SO2的物质的量增大
B.第一次反应达到平衡时共放出热量176.4 kJ
C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
 非选择题
非选择题
13.常温下,向0.1 mol·L-1的CH3COONa溶液中逐滴滴加等浓度的HCl溶液,则下列关系正确的是
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.c(Na+)=c(CH3COOH)+c(CH3COO-)
D.c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
12.依托孕烯是一种激素类药物,结构如图所示。下列有关依托孕烯的说法正确的是
 A.依托孕烯的分子式为C21H28O2
A.依托孕烯的分子式为C21H28O2
B.依托孕烯能与FeCl3溶液发生显色反应
C.l mol依托孕烯最多能与5 mol氢气发生加成反应
D.依托孕烯能发生氧化、还原、消去、水解等反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com