
题目列表(包括答案和解析)
24.已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
③ c(CH3COO-)>c(Na+)>c(H+)>c(OH-) ④ c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 。
(3)上述关系中不可能成立的是 (填序号),你判断的理由是 。
23.反应2A(g)+B(g)  3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:
3C(g),起始时按5∶2的体积比将A、B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达到平衡时混合气体中C的体积分数为60%。求:
(1)A、B的转化率分别为:αA= ,αB= 。
(2)平衡混合气体的平均相对分子质量(设A的相对分子质量为MA,B的相对分子质量为MB):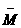 = 。
= 。
(3)平衡时压强与起始相比,有何变化? (填“增大”“不变”或“减小”)。
22.氧是人们熟知的生命元素之一,氧的研究对于化学科学的发展起到了重大的推动作用。
 (1)氧元素在元素周期表中的位置是______________________。请在下图中标出基态氧原子的核外电子排布情况。
(1)氧元素在元素周期表中的位置是______________________。请在下图中标出基态氧原子的核外电子排布情况。
(2)在化合物中氧元素一般显示-2价,有时也显示-1价。某A2B2型离子化合物含有-1价O,1mol该化合物含有54mol电子,请写出其电子式__________。氧只能与元素周期表中的某一种元素反应生成含+2价氧的化合物。该化合物的化学式
为____________。
21.第四周期元素中,4p轨道半充满的是_____________,3d轨道半充满的是__________,4s轨道半充满的是____________。(以上均填元素符号)
20.用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为
A.阳极100 g,阴极128 g B.阳极93.6 g,阴极121.6 g
C.阳极91.0 g,阴极119.0 g D.阳极86.0 g,阴极114.0 g
第Ⅱ卷(非选择题 共40分)
19.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4+8H2O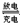 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是( )
A.放电时锌做负极
B.充电时氢氧化铁被氧化
C.充电时电池的正极和电源的正极相连
D.放电时每转移3 mol e-,有2 mol FeO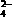 被还原
被还原
18.某学生欲完成反应2HCl+2Ag 2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是
2AgCl↓+H2↑而设计了下列四个实验,你认为可行的是
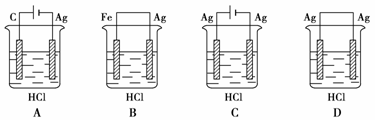
17.用惰性电极电解足量的下列溶液,一段时间后,加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
A.CuCl2[CuSO4] B.NaOH[NaOH]
C.NaCl[HCl] D.CuSO4[Cu(OH)2]
16.取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A. 0.05 mol/L B.0.017 mol/L C. 0.01 mol/L D.0.50 mol/L
15.在pH为3的FeCl3溶液、pH为11的Na2CO3溶液和pH为3的盐酸中,由水电离出来的H+的浓度分别为c1、c2、c3,它们之间的关系是( )
A.c1<c2<c3 B.c1=c2>c3 C.c1>c2>c3 D.无法判断
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com