
题目列表(包括答案和解析)
19.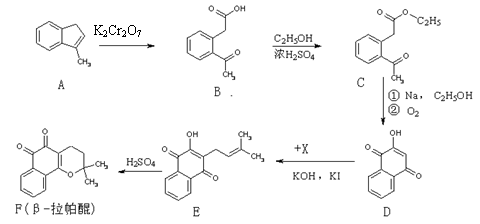 (14分)β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下:
(14分)β-拉帕醌(β-lapachone)是一种抗癌新药,合成路线如下:
(1)已知X的分子式为C5H9Cl,则X的结构式为: ▲ 。
(2)反应类型A→B ▲ 。
(3)上述反应中,原子利用率达100%的是 ▲ (选填:“A→B”、“B→C”、“D→E”、“E→F”)。
(4)D→E发生的是取代反应,还有一种副产物与E互为同分异构体,且属于醚类,该物质的结构简式为: ▲ 。
(5)化合物B的同分异构体很多,满足下列条件的同分异构体数目有 ▲ 种(不包括立体异构)。
①属于苯的衍生物 ②苯环上有两个取代基
③分子中含有一个手性碳原子 ④分子中有一个醛基和一个羧基
(6)已知:双烯合成反应: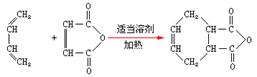 ,
,
试由2-甲基-1,3-丁二烯和乙烯为原料(无机试剂及催化剂任用)合成高分子
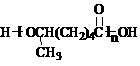 。
。
提示:合成路线流程图示例如下: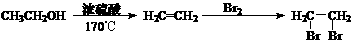
18.(12分) 氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
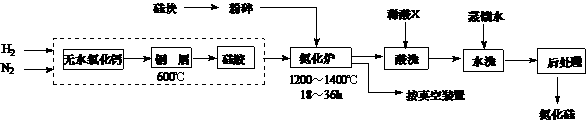
(1)净化N2和H2时,铜屑的作用是: ▲ ;硅胶的作用是 ▲ 。
(2)在氮化炉中3SiO2(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ▲ ;体系中要通入适量的氢气是为了 ▲ 。
(3)X可能是 ▲ (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)。
(4)如何说明氮化硅产品已用水洗干净? ▲ 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: ▲ 。
17.(8分)生物质资源是一种污染小的可再生能源。生物质的主要转化途径及主要产物如下图。
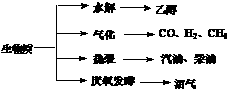 (1)下列有关说法正确的是 ▲ 。
(1)下列有关说法正确的是 ▲ 。
a.生物质能,本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸杆等发酵获得的沼气,主要成是甲烷
(2)由生物质能获得的CO和H2,当两者1∶1催化反应,其原子利用率达100%,合成的物质可能是 ▲ 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)已知在生物质气化炉中可发生:
C(s) + CO2(g) = 2CO(g) △H= 172kJ/mol
CH4(g)+ H2O(g) = CO(g) + 3H2(g) △H= 206kJ/mol
CH4(g)+ 2H2O(g) = CO2(g) + 4H2(g) △H= 165kJ/mol
则:C(s) + H2O(g) = CO(g) + H2(g) △H= ▲ kJ/mol。
(4)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
|
气化反应式 |
lgK |
||
|
700K |
900K |
1200K |
|
|
C(s)+H2O(g)=CO(g)+H2(g) |
-2.64 |
-0.39 |
1.58 |
|
C(s)+2H2O(g)=CO2(g)+2H2(g) |
-1.67 |
-0.03 |
1.44 |
反应:CO(g) + H2O(g)  CO2(g) + H2(g),该反应的△H ▲
0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)= ▲ 。
CO2(g) + H2(g),该反应的△H ▲
0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)= ▲ 。
16.(10分)美国科学家理查德-海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。一种由废催化剂制取氯化钯的工艺流程如下:
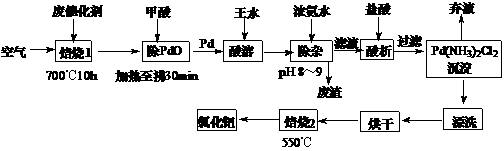
(1)甲酸在反应中的作用是 ▲ (选填:“氧化剂”、“还原剂”)。
(2)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 ▲ (写化学式)。
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为: ▲ 。
(4)700℃焙烧1的目的是: ▲ ;550℃焙烧2的目的是: ▲ 。
15.(12分)NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤ ▲ 。
⑥ ▲ 。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生: ▲ 。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是: ▲ 。
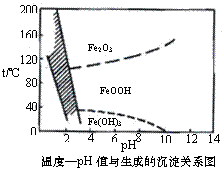 (3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2-4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。右图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。
下列说法正确的是 ▲ (选填序号)。
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O d.工业生产中温度常保持在85-95℃生成黄铁矾钢,此时水体的pH约为1.2-1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是: ▲ 。
(5)补充上述步骤⑤和⑥[可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸]。
14.工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g)
+ H2O(g)  CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
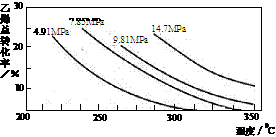
A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250-300℃,主要是在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率
D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动
非选择题
13.已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期, D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是
A.原子半径:D>E>B>C>A
B.热稳定性:EA4>A2C
C.单质D可用海水作原料获得
D.化合物DC与化合物EC2中化学键类型相同
12.下列溶液中微粒的物质的量浓度关系正确的是
A.0.1mol/LNaHS溶液:c(OH-)=c(H+) + 2c(H2S)+c(HS-)
B.常温下,pH≈5.5的0.1mol/LNaHSO3溶液:c(Na+)>c(HSO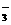 )>c(H2SO3)>c(SO
)>c(H2SO3)>c(SO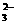 )
)
C.25℃时,pH=9.4,浓度均为0.10 mol/L的HCN与NaCN的混合溶液:
c(Na+)>c(CN-)>c(HCN)>c(OH-)
D.浓度均为0.1mol/L的Na2CO3与NaHCO3混合溶液:
c(Na+)>c(HCO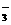 )>c(CO
)>c(CO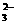 )>c(OH-)
)>c(OH-)
11.我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:
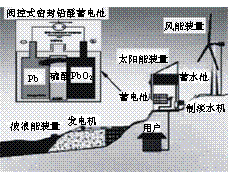 Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,
Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,
下列有关说法正确的是
A.图中涉及的能量转化方式只有3种
B.蓄电池供电时,负极的电极反应为:
Pb +SO42―-2e-=PbSO4
C.储能时若充电时间过长,阳极流向阴极的气体可
能是H2
D.该发电工艺可实现零排放
10.下列实验操作与预期目的或所得结论一致的是
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 |
说明该钠盐是硫酸钠或硫酸氢钠 |
|
B |
向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 |
得到较纯净的乙酸乙酯 |
|
C |
向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 |
说明汽油中含有甲苯等苯的同系物 |
|
D |
向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 |
除去FeCl2溶液中的FeBr2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com