
题目列表(包括答案和解析)
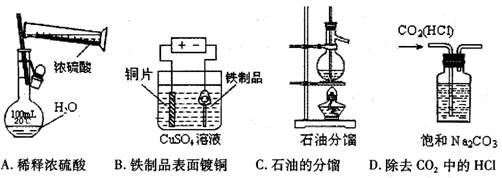
5. 下列实验装置、试剂选用或操作正确的是
6 下列各组离子在溶液中能大量共存的是 ,
A.
无色透明的溶液中: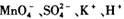 I
I
B.
含有大量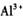 的溶液:
的溶液: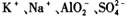
C.
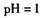 的溶液中:
的溶液中: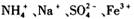
D.
水电离产生的 的溶液中:
的溶液中: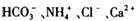
4. 用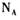 表示阿伏加德罗常数的数值。下列说法正确的是
表示阿伏加德罗常数的数值。下列说法正确的是
A.
在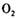 参与的反应中,
参与的反应中,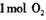 作氧化剂时得到的电子数一定是
作氧化剂时得到的电子数一定是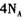
B.
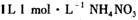 的溶液中氮原子数小于
的溶液中氮原子数小于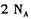
C.
常温常压下,11.2g乙烯中含有共用电子对数目为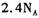
D.
标准状况卞,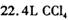 中所含有的分子数为
中所含有的分子数为
3. “类推”的思维方式在化学学习与研究中经常采用,但是有时会产生错误结论。下列类推结论中,正确的是
A. 由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.
由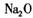 中阳离子与阴离子的个数比为2:1,可推出
中阳离子与阴离子的个数比为2:1,可推出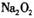 中阳离宇与阴离子的个数比为1:1
中阳离宇与阴离子的个数比为1:1
C 由“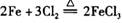 ”反应可推出“
”反应可推出“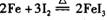 ”反应也能发生
”反应也能发生
C. Na,K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
25.硫酸锌可作为食品锌强化剂的原料,工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:

(1)将菱锌矿研磨成粉的目的是 。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□ +□ =□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为 。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀pH |
10.4 |
6.4 |
- |
- |
|
沉淀完全pH |
12.4 |
8.0 |
- |
- |
|
开始溶解pH |
|
10.5 |
- |
- |
|
KSP |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是 (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 、 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 。


24.(11分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔沸点数据见下表
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
I.(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理 。(填“合理”或“不合合”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好是 (填序号)并说明理由: 。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
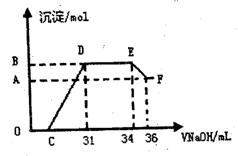 II.实验研究发现,硝酸发生氧化还原反应时,
II.实验研究发现,硝酸发生氧化还原反应时,
硝酸的浓度越稀,对应还原产物中氮元素
的化合价越低。为了测定熔融物与足量很
稀的硝酸充分反应,反应过程中无气体
放出。在反应结束后的溶液中,逐滴加入
4mol/LNaOH溶液,所加NaOH溶液的体
积(mL)与产生的沉淀的物质的量(mol)
的关系如图所示。试回答下列问题:
(1)逐滴加入4mol/ L NaOH溶液的定量玻璃仪器是 ,图中OC段没有沉淀生成的原因是: (用离子方程式表示)
(2)由上述图形分析可知,溶液中结合OH-的能力最强的离子是 (填离子符号,下同)最弱的离子是 。
(3)若测定F点沉淀的质量,需对混合物进行的处理是:过滤 、 、称量。
(4)用上图数据计算,熔融物中的两种金属的物质的量之比n(Fe):n(Al)= 。
23.(9分)合成氨工业的核心反应是:N2(g)+3H2(g)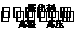 2NH3(g);△H=QkJ·mol-1能量变化如图所示,回答下列问题:
2NH3(g);△H=QkJ·mol-1能量变化如图所示,回答下列问题:
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1 ,E2 (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量(填“<”“>”或“=”) 46.2kJ,理由是 。
(3)关于该反应的下列说法中,正确的是 。
A.△H > 0, △S >0 B.△H > 0, △S <0
C.△H < 0, △S >0 D.△H < 0, △S <0
(4)将一定量的N2(g)和H2(g)放入1L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.1mol,H2为0.30mol,NH3为0.10mol。计算该条件下达的平衡时H2转化为NH3的转化率为 。该温度下的平衡常数K的值为 。若升高温度,K值变化 (填“增大”“减小”或“不变”)
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中的转化率,下列措施可行的是 (填字母)
A.向容器中按原比例再充分原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨
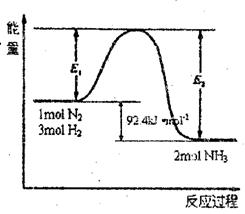
22.某课外活动小组用如下图甲装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为 。
(2)若开始时开关K与b连接,则B极的电极反应式为 ,总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(3)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用下图乙装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
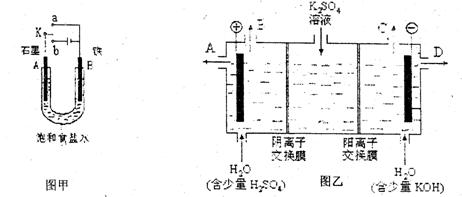
①该电解槽的阳极反应式为 。此时通过阴离子交换膜的离子数 (填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”) 导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为 。
21.如图所示涉及的物质所含元素中,除一种元素外,其余均为1-18号元素。已知:A、F 为无色气体单质,B为具有刺激气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列全)
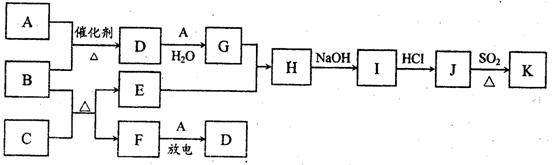
请回答下列问题:
(1)G的化学式为 。
(2)写出B与C反应的化学方程式 。
(3)J、K是同种金属的氯化物.且K为白色沉淀。写出SO2还原J生成K的离子方程 式____。
(4)汽军尾气中常含有D。B与D在加热和催化剂存在的条件下,发生反应生成两种 对空气无污染的物质。请写出该反应的化学方程式 。
20.以Pt为电极,电解含有0.10mol M+和0.10 mol N+(M+、N3+均为金属阳离子)的溶液阴 极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图。对离子氧化能力的强弱判断正确的是(选项中H+为氢离子) ( )
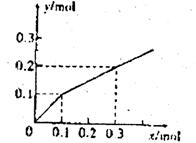 A.
A.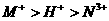
B.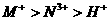
C.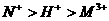
D.条件不足,无法确定
19.以水为溶剂进行中和滴定的原理是:H2O+OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(1)+SO2(1) SO2-3+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
SO2-3+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是 ( )
A.该滴定反应可以表示为:SO2-3+SO2+=2SO2
B.在一定温度下,液态SO2中c(SO2-3)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com