
题目列表(包括答案和解析)
16. 世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法中,不正确的是
A.向最后一次洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
B.上述变化过程中包括了分解、化合、复分解三种反应类型
C.步骤⑤也可以采用电解该盐水溶液的方法
D.为节省原料、减少污染,在提取镁的工业流程中使用了物质循环的过程
15.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
 2N2O5(g) 4NO2(g)+ O2(g) △H >0
2N2O5(g) 4NO2(g)+ O2(g) △H >0
T1温度下的部分实验数据为:
|
t/s |
0 |
500 |
1000 |
1500 |
|
c(N2O5)mol/L |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法中,不正确的是
A.当反应体系内气体的平均相对分子质量不再发生变化时则该反应达到了平衡
B.T1温度下的平衡常数为K1 =125,1000s时转化率为50%
C.其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1 >T2
D.T1温度下的平衡常数为K1 ,若维持T1温度不变,增加体系压强,达到新平衡时,平衡常数为K2,则K1> K2
14.下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液中:
c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:
c(M+)=c(A-)>c(OH-)=c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
13.下列实验操作或描述中,错误的是
A.将等物质的量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体
B.亚硝酸银和氯化银都是白色沉淀,故不能用硝酸银和稀硝酸溶液来区别亚硝酸钠与氯化钠
C.海带中碘元素的分离及检验时,需要向海带灰的浸取液中加入少量稀硫酸和过氧化氢溶液将I- 氧化成I2
D.纸层析法分离铁离子和铜离子实验中,点样后的滤纸晾干后将其末端浸入展开剂中约0.5cm
12.用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.在同温同压下,相同体积的任何气体单质所含的原子数目相同
C.14 g乙烯和丙烯的混合物中总原子数为3NA个
D.含2molH2SO4的浓硫酸与足量的铜片在加热条件下反应,一定能产生NA个SO2气体分子
11.下列离子方程式正确的是
A.硫化钠的水解反应:S2-+ H3O+= HS-+ H2O
B.氧化铝溶解在NaOH溶液中:3H2O + Al2O3 + 2OH- = 2Al(OH)4-
C.硫酸铝溶液与氢氧化钡溶液反应,使SO42- 恰好沉淀完全
Al3+ + SO42- + Ba2+ + 3OH- = BaSO4 ↓+ Al(OH)3↓
D.在漂白粉配制成的溶液中通入SO2: Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
10.化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是
A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀
B.淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解
C.将Na2SO4·10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水
D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl
溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点
9.著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。
下列说法正确的是
A.铈(Ce)元素在自然界中主要以单质形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce + 4HI = CeI4 + 2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+ = Ce3++2Fe3+
D.四种稳定的核素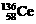 、
、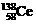 、
、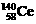 、
、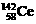 ,它们互称为同位素
,它们互称为同位素
8.下列排列顺序中,正确的是
|
③密度:四氯化碳>己烷>水 ④结合质子能力:OH-> >HCO3-
A.①③ B.①④ C.②④ D.②③
7.关于下列各装置图的叙述中,正确的是
|
|
|
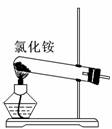
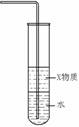
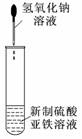
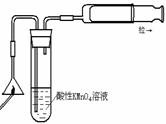
① ② ③ ④
A.实验室用装置①制取氨气
B.装置②中X若为苯,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④可用于检验火柴头燃烧产生的SO2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com