
题目列表(包括答案和解析)
2.下列物质的熔、沸点高低顺序中,正确的是 ( )
A.金刚石 >晶体硅 >二氧化硅 >碳化硅 B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O D.金刚石>生铁>纯铁>钠
1.下列关于粒子结构的描述不正确的是 ( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含一个极性键的18电子粒子
C.CH2Cl2和CCl4均是四面体构型的非极性分子
D.1 mol D216O中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值)
23.(8分)据报道:2007年1月30日107国道湖北孝感段发生危险化学品泄漏, 上百人中毒。经医学诊断为高毒类有机物硫酸二甲酯泄漏引发的人员中毒。该物质在有机合成中用作甲基化试剂(提供-OCH3)。但随着对此研究的深入,该有毒物质的应用范围越来越小,相信不久将被无毒的有机物M完全取代.
现有一种有机香料A是经过有机物M作为甲基化试剂合成的(注意:取代基不能全部相邻)。
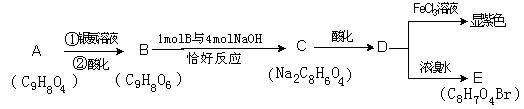
(1)有机物M结构的球棍模型如图所示: 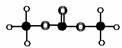
有机物M的分子式为:
(2)A分子中的官能团的是 ;(除甲氧基外)
(3)根据上述信息 (填可以或不能)确定A的结构式
(4)A可以发生的反应是 (填符号);
a 消去反应 b氧化反应 c 酯化反应 d水解反应
(5)符合题目要求的可能的A的结构简式_______________________
(6)写出下列反应的化学方程式(有机物用结构简式表示)
D → E 反应类型__________________
22.(8分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为__________。
(2)写出与H2O分子互为等电子体的微粒__________。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对其过程的描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______(请用相应的编号填写)
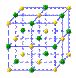

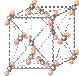
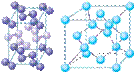
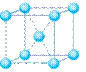
A B C D E
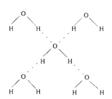 (5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
21.(8分)科学家预测“氢能”将是未来最理想的新能源。请回答下列问题:
(1)实验测得,1g氢气燃烧生成液态水放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为 ( )
A.2H2(g) + O2(g) = 2H2O(l); △H =-142.9 kJ/mol
B.H2(g) + 1/2O2(g) = H2O(l); △H =-285.8 kJ/mol
C.2H2(g) + O2(g) = 2H2O(l);△H =-571.6 kJ/mol
D.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8 kJ/mol
(2)根据“绿色化学”的思想,为了制备H2,某化学家设计了下列化学反应步骤:
①CaBr2+H2O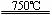 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg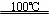 HgBr2+H2↑
HgBr2+H2↑
③HgBr2+CaO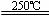 HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑
上述过程的总反应可表示为 。
(3)利用核能把水分解,制出氢气,是目前许多国家正在研究的课题。下图是国外正在研究中的一种流程(硫-碘热循环法),其中用了过量的碘。
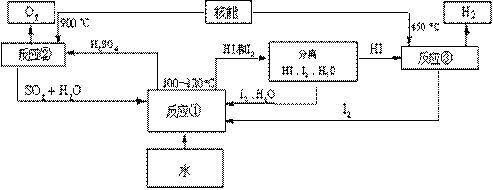
请写出反应①的化学方程式: 。
用硫-碘热循环法制取氢最大的优点是 。
(4)也有人认为利用氢气作为能源不太现实。你的观点呢?请说明能够支持你的观点的两点理由 。
20.(8分)将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
① 取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
② 另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③ 再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;请根据以上实验中得到的数据分析计算:
⑴ 原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵ 所得混合溶液中c(Cu2+)的取值范围;
⑶ 若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
19.(10分) 已知物质M由X、Y两短周期且同周期元素组成,X原子的最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价的代数和为6,M与其它物质的转化关系如下(部分产物已略去)
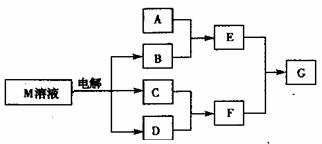
(1)若A是与X、Y同周期元素的一种单质,当F的水溶液过量时,G为可溶性盐,当F的水溶液不足时,G为沉淀,则E与过量F溶液反应的离子方程式为____________
(2) 若A是一种常见酸性氧化物,且可用于制造玻璃,则A与B反应的化学方程式为______
 (3) 若A是一种常见化肥,式量为78,且E与F反应生成G时有白烟产生,则溶液中A与足量B加热时反应的离子方程式为__________
(3) 若A是一种常见化肥,式量为78,且E与F反应生成G时有白烟产生,则溶液中A与足量B加热时反应的离子方程式为__________
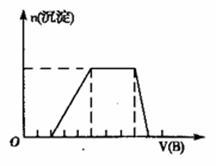
(4)若A是一种溶液,只可能是含有H+、NH4+ 、Mg2+ 、Al3+ 、Fe3+、CO32、SO42- 中的某些离子,当向溶液中加入B溶液时,发现生成沉淀的物质的量随B溶液的体积变化如图所示,由此可知,该溶液中肯定含有的离子是 ____________,且各离子的物质的量之比为________________ 。
18.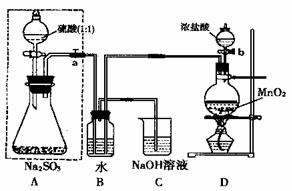 (14分)长期存放的Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。请回答:
(14分)长期存放的Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测定某无水Na2SO3被氧化的程度。请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,应如何检查虚线框内装置的气密性?
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,上述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
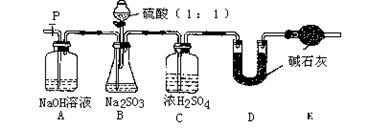 (Ⅱ)乙同学设计了另一套实验装置如下图:
(Ⅱ)乙同学设计了另一套实验装置如下图: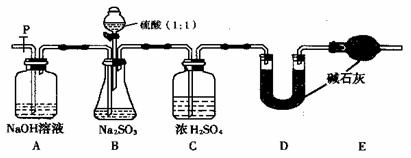
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO3样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量硝酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将滤液蒸干,称量得固体m3g
D.将样品溶解,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
17. (12分) 2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。表面化学领域的研究可以帮助我们了解众多纷杂的化学过程,如钢铁为何会生锈,燃料电池如何作用以及某些反应的催化剂是如何发挥其功能的,甚至可以解释臭氧层的消耗现象等。
(12分) 2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。表面化学领域的研究可以帮助我们了解众多纷杂的化学过程,如钢铁为何会生锈,燃料电池如何作用以及某些反应的催化剂是如何发挥其功能的,甚至可以解释臭氧层的消耗现象等。
⑴某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。
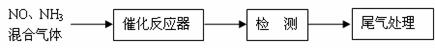
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通过滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 。
⑵在汽车的排气管上安装“催化转化器”(用铂、钯合金作催化剂),它的作用是使CO、NO反应生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧。
写出CO与NO反应的化学方程式: ,该反应作氧化剂的物质是_________。
⑶①有人认为:该研究可以使氨的合成反应,在铁催化剂表面进行时的效率大大提高,从而使原料的转化率大大提高。请你应用化学基本理论对此观点进行评价: 。
|
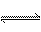 2NH3 △H<0
2NH3 △H<0
该反应的平衡常数K的表达式为:K=_______。升高温度,K值 (填“增大”、“减小”或“不变”)。
③合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2 Fe2O3十C 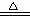 4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
4FeO十CO2↑。为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为
g。
16.下表为有关化合物的pksp,pksp=-lgksp。某同学设计实验如下:①向AgNO3溶液中加入适量NaX溶液,得到沉淀AgX;②向①中加NaY ,则沉淀转化为AgY;③向②中加入Na2Z,沉淀又转化为Ag2Z。则表中a、b、c的大小关系为 ( )
|
相关化合物 |
AgX |
AgY |
Ag2Z |
|
pksp |
a |
b |
c |
A.a>b>c B.a<b<c C.c<a<b D.a+b=c
第Ⅱ卷 (非选择题 共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com