
题目列表(包括答案和解析)
3. 下列各组物质中,全部是弱电解质的是
A. CH3COOH、H3PO4、C2H5OH B. Cu(OH)2、H2S、Cl2yjw
C. H2O、NH3·H2O、HF D. H2SO3、HI、BaSO4
2. 下列化学用语书写正确的是
A. 异丁烷的结构式: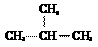 B. Li原子的轨道表示式:
B. Li原子的轨道表示式: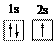
C. 二氧化碳的电子式: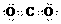 D. 饱和醇的通式:CnH2n+2O
D. 饱和醇的通式:CnH2n+2O
1. “绿色商品”是指商品从原料、生产到运输、使用等各环节对生态环境无害或危害极小,并有利于资源的保护和再回收的商品。下列肯定不属于“绿色商品”的是
A. 一次性餐具 B. LED照明灯具 C. “FreeForest”再生纸 D. 竹制家具
31.火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100℃-1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.20),主要反应为:
焙烧炉中:2ZnS(s) + 3O2(g) → 2ZnO(s) + 2SO2(g) ①
鼓风炉中:2C(s) + O2(g) →2CO ②
鼓风炉中:ZnO(s) + CO(g) Zn(g)+CO2(g)
③
Zn(g)+CO2(g)
③
(1)已知闪锌矿中含硫16%(其它杂质不含硫),则闪锌矿中硫化锌的含量为 。
(2)焙烧炉产生的炉气中SO2的体积分数不超过 %(保留小数后一位数字)。
⑶鼓风炉容积固定,炉内部分气态物质其物质的量浓度(mol/L)变化如下:
|
时间/min |
CO |
Zn |
CO2 |
|
0 |
0.11 |
0 |
0 |
|
2 |
0.10 |
0.01 |
0.01 |
|
3 |
0.01 |
0.10 |
0.10 |
|
4 |
0.01 |
0.10 |
0.10 |
则鼓风炉中CO总的转化率为 ;若生产中CO总的利用率为95%,则每生产1molZn,至少需要补充焦炭 g。
⑷若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余,则每生产1mol Zn,应向焙烧炉和鼓风炉中鼓入新鲜空气共 L(S.T.P)。
卢湾区2010学年第一学期高三年级期末考试
30.白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、Si、H的氧化物表示)。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为____________g/mo1。
(2)另取4.05g白玉粉末加入lmol/L的盐酸l00mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则
①p=_______;②白玉的化学式为______________________________。
29. (13分)
 已知:
已知:
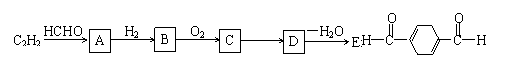 以乙炔为原料,通过下图所示步骤能合成有机物中间体E(转化过程中的反应条件及部分产物已略去)。
以乙炔为原料,通过下图所示步骤能合成有机物中间体E(转化过程中的反应条件及部分产物已略去)。
其中,A、B、C、D分别代表一种有机物;B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1)A→B的化学反应类型是 。
(2)写出生成A的化学方程式: 。
(3)B在浓硫酸催化下加热,可生成多种有机物。写出2种相对分子质量比A小的有机物的结构简式:
、 。
(4)写出C生成D的化学方程式:
。
(5)含有苯环,且与E互为同分异构体的酯有 种,写出其中二种同分异构体的结构简式:
。
28.有机物A,俗称水杨酸,其结构简式为: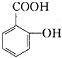
已知: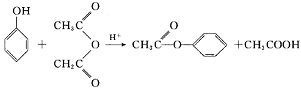
(1)将A跟下列物质的溶液反应可以得到一种钠盐(其化学式为C7H5O3Na)是
。
A.NaOH B.Na2CO3 C.NaHCO3 D.NaCl
(2)水杨酸的同分异构体中,属于酚类,同时还属于酯类的化合物有 种,其结构简式分别为 。
(3)水杨酸的同分异构体中,属于酚类,但不属于酯类,也不属于羧酸类的化合物一定含有 基(填写除了羟基以外的官能团名称)
(4)水杨酸在酸性条件下与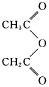 反应合成阿司匹林,则阿司匹林的结构为
。可以检验阿司匹林样品中混有水杨酸的试剂是
。
反应合成阿司匹林,则阿司匹林的结构为
。可以检验阿司匹林样品中混有水杨酸的试剂是
。
A.三氯化铁溶液 B.碳酸氢钠 C.石蕊试液
26.为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL-50mL),供量气用,乙管可上下移动,用来调节液面高低。
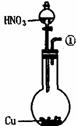
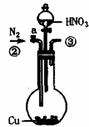
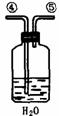
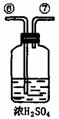
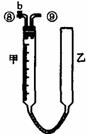
A B C D E
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择 (填装置序号)。
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是 。
(3)装置的连接顺序是(填各装置接口的编号,连结胶管及夹持装置均省略) 。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向E装置右管中加适量水;
第二 。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是 。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m= 。
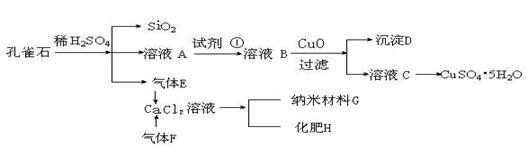
27.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下:

 请回答下列问题:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 ,
加入CuO作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过 操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入) (填化学式)。
写出该反应的化学方程式 。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
25.工业制硝酸的主要反应是:
4NH3(g)+5O2(g)
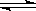 4NO(g)+6H2O
(g)+1025 kJ
4NO(g)+6H2O
(g)+1025 kJ
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
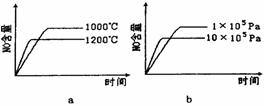
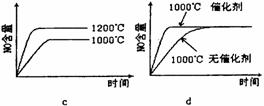
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填字母序号)。
(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是_________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填字母序号)。
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是_______________________________。
24.亚硫酸钠和碘酸钾在酸性溶液中发生以下发应:

 Na2SO3+ KIO3+ H2SO4 __Na2SO4
+ K2SO4+ I2 +
Na2SO3+ KIO3+ H2SO4 __Na2SO4
+ K2SO4+ I2 +
 (1)配平上面的方程式,在横线上填入系数,在 填上反应产物
(1)配平上面的方程式,在横线上填入系数,在 填上反应产物
(2)其中氧化剂是 ,若反应中有2.5mol电子转移,则生成的碘是 mol;氧化产物为 mol。
(3)该反应的过程和机理较复杂,一般认为发生以下四步反应:
 ① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
① IO3-
+SO32 -
IO2- + SO42 - (反应速率慢)
 ② IO2-
+ 2SO32 - I- + 2SO42
- (反应速率快)
② IO2-
+ 2SO32 - I- + 2SO42
- (反应速率快)
 ③ 5I- +6H+
+IO3- 3I2
+3H2O (反应速率快)
③ 5I- +6H+
+IO3- 3I2
+3H2O (反应速率快)
 ④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
④ I2 +SO32
- +H2O I- +
SO42 -+2H+ (反应速率快)
根据上述步骤推测该反应总的反应速率由_____(填反应编号)步反应决定。
(4)预先加入淀粉溶液,由上述四步反应可以看出必须在_____离子消耗完后,才会使淀粉变蓝的现象产生。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com