
题目列表(包括答案和解析)
23. 能源材料已成为当今科学研究的热点。请回答下列问题:
|
|
I1 |
I2 |
I3 |
I4 |
…… |
|
电离能(kJ/mol) |
738 |
1451 |
7733 |
10540 |
…… |
(1)单质A的燃烧热大,可作燃料。已知A为短周期元素,其气态原子逐个失去1~ 4个电子所需能量(电离能)如右表所示,某同学推断A的核外电子排布为:1s22s22p63s13p1,该电子排布式违背了____________;若该原子核外电子确有三层,则该元素位于周期表_______族,写出A燃烧后形成的氧化物的电子式:____________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。继C60后,科学家又合成了Si60、N60,下列有关说法正确的是_______(填序号)。
a. C60、Si60、N60都属于新型化合物 b. C60、Si60、N60互为同分异构体
c. 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2
d. 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石
|
(3)超导材料在节能、储能方面的应用。右图是超导材料元素在周期表中的分布,其中短周期元素中原子半径最大的是_____(填元素符号),其原子最外层有______种运动状态不同的电子,写出其最高价氧化物对应水化物的电离方程式: _________________________________________。 |
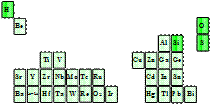 |
|
24. 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。请回答下列问题: (1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为_________,还原产物是________。 (2)已知b→c过程中,仅有一种元素发生化合价变化,写出并配平该反应的离子方程式_______________。 |
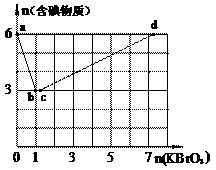 |
(3)① 已知反应:2BrO3- +I2 → 2IO3- + Br2;有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由:
____________________________________________________________________________。
②n(KBrO3) = 4时,对应含碘物质的化学式为______________。
(4)含a mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为___________。
22. 常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得滴
|
定曲线如右图。下列说法正确的是 A. 点①所示溶液中: c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) B. 点②所示溶液中: c(Na+) < c(CH3COO-) + c(CH3COOH) C. 点③所示溶液中: c(Na+) > c(OH-) > c(CH3COO-) > c(H+) |
 |
D. 滴定过程中可能出现:c(CH3COOH) > c(H+) > c(CH3COO-) > c(Na+) > c(OH-)
第II卷(共84分)
21. 向15.0 mL 1.0 mol·L-1的(NH4)Al(SO4)2溶液中逐滴加入1.0 mol·L-1的NaOH溶液,并不断搅拌。当生成0.78 g沉淀时,所用NaOH溶液的体积可能为
A . 30 mL B. 45 mL C. 50 mL D. 65 mL
20. 下列离子方程式书写正确的是
A. 硫酸铜溶液与氢氧化钡溶液反应:SO42- + Ba2+ → BaSO4↓
B. 稀硝酸中加入少量碳酸亚铁:FeCO3 + 2H+ → Fe2+ + CO2↑+ H2O
C. 硫酸氢铵溶液中滴入几滴氢氧化钠溶液:H+ + OH- → H2O
D. 饱和碳酸钠溶液中通入二氧化碳气体:2Na+ + CO32- + CO2 + H2O → 2NaHCO3↓
19. 已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH
+ H2O 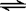 CH3COO- + H3O+ K1=1.75×10-5
CH3COO- + H3O+ K1=1.75×10-5
CH3COO- + H2O 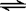 CH3COOH + OH- K2=5.71×10-10
CH3COOH + OH- K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
A. 甲溶液的pH >7
B. 对甲进行微热,K1、K2同时增大
C. 若在甲中加入少量的NaOH溶液,溶液的pH几乎不变
D. 若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大
18. NA表示阿伏伽德罗常数,下列叙述正确的是
A. 1 mol Cu和足量浓硝酸反应可收集NO2的分子数为2 NA
B. 4℃时,3.6 mL 水所含的电子数为2 NA
C. 30.8 g熟石膏(2CaSO4·H2O)中的钙离子数目为0.20 NA
D. 200 mL 0.5 mol·L-1的Na2CO3溶液中阴离子数目小于0.1 NA
17.下列图像表达正确的是
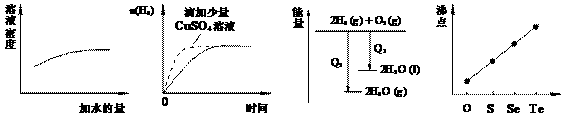
|
A. 氨水的稀释 |
B. 等质量锌粉与 足量盐酸反应 |
C. 氢气与氧气反应 中的能量变化 |
D. 气态氢化物沸点 |
16. 下表中,陈述I、II均正确,且两者间有因果关系的是
|
选项 |
陈述I |
陈述II |
|
A. |
碳酸钠可用于治疗胃酸过多 |
碳酸钠可与盐酸反应 |
|
B. |
金属镁失火能用二氧化碳灭火 |
二氧化碳不支持燃烧 |
|
C. |
明矾可用于净水 |
明矾水溶液呈酸性 |
|
D. |
过氧化钠可用作航天员的供氧剂 |
Na2O2能与CO2或水反应生成氧气 |
15. 在实验室中,下列除去括号内杂质的方法正确的是
A. 乙烷(乙烯):通入氢气,在一定条件下反应
B. 硝基苯(浓HNO3和浓H2SO4):加入NaOH溶液,振荡、静置、分液
C. 二氧化碳(二氧化硫):通过装有BaCl2(稀硝酸)溶液的洗气瓶
D. 溴苯(溴):加入KI溶液,分液
14. 下列关于实验现象或产物叙述正确的是
A. 铜粉与硫粉共热生成黑色CuS固体
B. 新制氯水中滴入紫色石蕊溶液,溶液显红色
C. 将无水乙醇加热到170℃时,可制得乙烯
D. 已知AgI的溶解度比AgCl更小,故在AgCl悬浊液中滴加KI溶液,能观察到黄色沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com