
题目列表(包括答案和解析)
3.
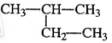
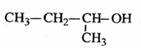 下列有机物命名正确的是
下列有机物命名正确的是
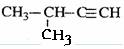
A. 2-甲基-3-丁炔 B. 2-甲基-1-丙醇 C. 2-甲基丁烷 D. 二氯丙烷
2. 下列有关表述正确的是
2s 2p
|
↑↓ |
|
↑ |
↑ |
↓ |
A. N原子的价电子轨道表示式:
B.碳酸氢钠在水溶液中的电离方程式:NaHCO3 Na++H++CO32-
Na++H++CO32-
 C.羧基的结构式:
C.羧基的结构式:
D. 明矾的化学式为 KAlSO4·12H2O
1. 化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D. 为提高农作物的产量和质量,应大量使用化肥和农药
31. 将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入100mL 9mol/L的硝酸中,充分反应后,固体全部溶解,硝酸只被还原成NO2和NO(假设生成气体全部逸出),反应后溶液中H+ 为0.16mol(不考虑Cu2+ 的水解)。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数(保留2位小数)。
(2)铜片与硝酸充分反应后,溶液中NO3-的物质的量浓度(假设反应前溶液的体积不变)。
(3)生成NO2和NO气体的体积比。
(4)已知2NO2+2NaOH→NaNO3+NaNO2+H2O,NO+NO2+2NaOH→2NaNO2+H2O。现将反应后生成的气体用过量NaOH溶液吸收,为使氮氧化物充分吸收,还需通入一定量氧气。
①最少应通入氧气的体积(标准状况)。
②参加反应的NaOH的物质的量。
虹口区2010学年第一学期期末高三化学练习题
30. 臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:3O2  2O3。
2O3。
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气体的平均摩尔质量为____(保留1位小数)。
(2)将8 L氧气通过放电管后,恢复到原状况,得到气体6.5 L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,充分加热后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为_____________。
29. 乙基香草醛( )是食品添加剂的增香原料。
)是食品添加剂的增香原料。
(1)写出乙基香草醛分子中两种含氧官能团的名称_______________________。
(2)与乙基香草醛互为同分异构体,能与NaHCO3溶液反应放出气体,且苯环上只有一个侧链(不含R-O-R’及R-O-COOH结构)的有______种。
(3)A是上述同分异构体中的一种,可发生以下变化:

已知:i. RCH2OH RCHO;
RCHO;
ii. 与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基。
①写出A的结构简式:_______________,反应②发生的条件是_________________。
②由A可直接生成D,反应①和②的目的是___________________________________。
③写出反应方程式:A→B__________________________________________________,
C与NaOH水溶液共热:_____________________________________________________。
(4)乙基香草醛的另一种同分异构体E(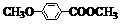 )是一种医药中间体。由茴香醛(
)是一种医药中间体。由茴香醛(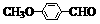 )合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。
)合成E(其他原料自选),涉及的反应类型有(按反应顺序填写)_______________________。
28. 橡胶是具有弹性的高分子化合物。除天然橡胶外,还有合成橡胶。
(1)天然橡胶的单体为异戊二烯,其结构简式为_________________,系统命名为__________。
(2)异戊二烯的同分异构体有很多,其中只有1个官能团的链烃有_______种。
(3)1,3-丁二烯是最早用于合成橡胶的原料,聚合产物结构随聚合条件、方法及所用催化剂的不同而异。请用化学方程式表示两种聚合方式:① ____________;② ____________。
 (4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示:
(4)橡胶高分子链中由于含有不饱和结构,弹性、强度、耐热和抗氧化性均较差,“硫化”可将橡胶链中的不饱和结构通过硫键(-Sx-)打开彼此相连形成网状结构,以改善其性能。现有某橡胶硫化后的部分结构如下所示:
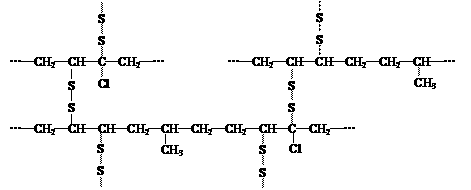
从结构看,合成这种橡胶的单体至少有(用结构简式表示):_____________________________。
27. 红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基础化工原料。铬常见价态有+3、+6价。铬的主要自然资源是铬铁矿FeCr2O4(含有Al2O3、MgO、SiO2等杂质),实验室模拟工业以铬铁矿为原料生产红矾钠的主要流程如下:
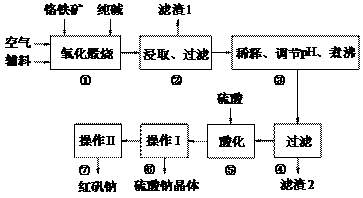
①中主要反应:4 FeCr2O4 + 8Na2CO3 + 7O2
 8Na2CrO4 + 2Fe2O3
+ 8CO2
8Na2CrO4 + 2Fe2O3
+ 8CO2
①中副反应:Al2O3 + Na2CO3  2NaAlO2 + CO2↑,
2NaAlO2 + CO2↑,
SiO2 +
Na2CO3  Na2SiO3 + CO2↑
Na2SiO3 + CO2↑
请回答下列问题:
(1)FeCr2O4化学名为亚铬酸亚铁,写出它的氧化物形式________________。步骤“①”的反应器材质应选用__________(填“瓷质”、“铁质”或“石英质”)。
 (2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。
(2)“②”中滤渣1的成分是__________, “③”中调pH值是_______ (填“调高”或“调低”),“④”中 滤渣2的成分是___________。
(3)“⑤”酸化的目的是使CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:__________________________。
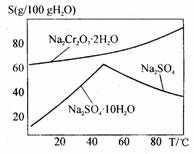
(4)右图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线,则操作I是______,操作II是______(填序号)。
①蒸发浓缩,趁热过滤 ②降温结晶,过滤
(5)已知某铬铁矿含铬元素34%,进行步骤①~④中损失2%,步骤⑤~⑦中产率为92%,则1吨该矿石理论上可生产红矾钠_______吨(保留2位小数)。
26. 硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。
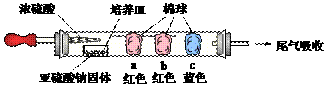
|
棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
|
a |
_______________ |
棉球变白, 微热后又恢复红色 |
解释:_____________________________ 结论:该气体具有漂白性。 |
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
|
c |
_______________ |
棉球变为白色 |
化学方程式: _________________________ 结论:该气体具有_________性。 |
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入
|
溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。 ① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
|
 |
② 若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为_________(填化学式)。此火焰温度极高,叫做________,常用于切割焊接金属。
25. 三种不同条件下,分别向容积固定的2L密闭容器中充入2molA和1mol B,发生反应如下:2A (g) +B (g)  2D (g) + Q,相关条件和数据见下表。
2D (g) + Q,相关条件和数据见下表。
|
|
实验I |
实验II |
实验III |
|
反应温度 / ℃ |
800 |
800 |
850 |
|
达平衡时间 /min |
40 |
10 |
30 |
|
c( D )平衡 /mol·L-1 |
0.5 |
0.5 |
0.15 |
|
反应的能量变化 / kJ |
Q1 |
Q2 |
Q3 |
请回答:
(1)实验III,反应进行到30min时的平均速率v (D)为_________________。
(2)实验II可能隐含的反应条件是________________________________________。
(3)下列描述中能说明上述反应已达平衡的是__________(填序号)。
a. c(A) = 2 c(B) b. 2 v (D)正 = v (B)逆
c. 容器内气体密度不随时间而变化 d. 容器内气体压强不随时间而变化
(4)对比上述实验,可知该反应的反应热Q___0(填“>”或“<”),并将Q、Q1、Q2、Q3按从小到大的顺序排列:_______________________________。
(5)若实验I达到平衡后,保持温度不变,再向密闭容器中通入由1mol A和1mol D组成的混合气体,则平衡将_______________移动(填“正向”、“逆向”或“不”),新平衡状态时c(D)为____________mol·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com