
题目列表(包括答案和解析)
8.(1)(CN)2+2OH-══CN-+CNO-+H2O
(2)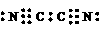 ,N≡C-C≡N,直线型、非极性
,N≡C-C≡N,直线型、非极性
(3)sp,3、4
11.(10分)氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式
。
⑵NH2-的电子式为 。 ⑶N3-有 个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式 。
⑸等电子数的微粒往往具有相似的结构,试预测N3-的构型 。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是 。
10.(1)利用VSEPR推断分子或离子的空间构型
PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
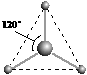 ________________;
________________; ___________________。
___________________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
9.根据下列要求,各用电子式表示一实例:
(1)只含有极性键并有一对孤对电子的分子
(2)只含有离子键、极性共价键的物质
(3)只含有极性共价键、常温下为液态的非极性分子
8.氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
(1)写出(CN)2与苛性钠溶液反应的离子方程式_______________________________;
(2)已知氰分子中键与键之间的夹角为180°,并有对称性,
则(CN)2的电子式为____________,结构式为____________________________,
分子空间构型为_______________,是__________分子(填“极性”或“非极性”);
(3)氰分子中碳原子为__________杂化;一个氰分子中包含_________个σ键,_______个π键。
7.下列关于主族元素的说法正确的是
A.主族元素的原子核外电子最后填入的能级是s能级
B.主族元素的原子核外电子最后填入的能级是s能级或p能级
C.主族元素的最高正价等于主族的序数 D.主族元素的价电子数有可能超过最外层电子数
6.下列说法正确的是: ( )
A.126g P4含有的P-P键的个数为6NA B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA D.60gSiO2中含Si-O键的个数为2NA
5.在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
4.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A 、 X与Y形成化合物是,X可以显负价,Y显正价
B 、第一电离能可能Y小于X
C 、 最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D 、气态氢化物的稳定性:HmY小于HmX
3.已知各种硝基苯酚的性质如下表
|
名称 |
结构式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
邻-硝基苯酚 |
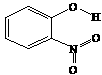 |
0.2 |
45 |
100 |
|
间-硝基苯酚 |
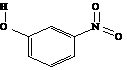 |
1.4 |
96 |
194 |
|
对-硝基苯酚 |
 |
1.7 |
114 |
295 |
下列关于各种硝基苯酚的叙述不正确的是 ( )
A.邻-硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间-硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对-硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com