
题目列表(包括答案和解析)
3.人体内产生的活性氧能加速人体衰老,被称为“生命杀手”。化学家尝试用Na2SeO3消除人体内活性氧,Na2SeO3在人体内的作用是
A.抗氧化剂 B.抗还原剂 C.抗酸剂 D.抗碱剂
2.科学家将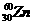 和
和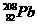 两种原子经核聚变获得112号新元素,该元素的一种核素的质量数为267。下列有关说法正确的是
两种原子经核聚变获得112号新元素,该元素的一种核素的质量数为267。下列有关说法正确的是
A.该元素位于第七周期第ⅡA族 B.该核素的中子数与质子数之差为43
C.该元素属于非金属元素 D.该元素的相对原子质量为267
1.绿色化学实验是在绿色化学思想指导下的实验新方法,以减少污染,防止浪费等。下列实验不符合绿色化学的是
A.用铜与浓硝酸反应制取硝酸铜,并用水吸收尾气yjw
B.在铜和浓硫酸反应的实验中,将铜片改为可调节高度的铜丝
C.用CCl4进行萃取操作练习时,用碘水代替溴水进行实验
D.测盐溶液的pH时,将pH试纸条剪成小块后使用
31.在标准状况下进行下列实验:甲、乙、丙各取30.00mL同浓度的盐酸,加入同一镁、铝合金,产生气体,测得有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量 |
0.255g |
0.385g |
0.459g |
|
气体体积 |
280mL |
336mL |
336mL |
(1)分析上表数据后填空:
①盐酸的物质的量浓度为 mol/L,在表中可作为计算依据的是(填实验序号,要求全部写出)
②据(填实验序号) 中的数据,可计算出合金中镁与铝的物质的量之比为
(2)在丙实验之后,向容器中加入一定量1.00mol/L的NaOH溶液,使合金中的铝恰好完全溶解,再滤出不溶固体请计算:
①滤液中溶质的物质的量
②加入NaOH溶液的体积
2010学年第一学期高三化学
30.(6分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0600mol。
(1)原NaOH溶液的质量分数为
(2)所得溶液中Cl-的物质的量为 mol
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
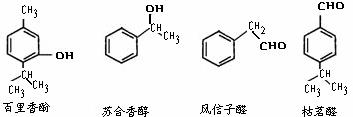
29. 以下几种物质是常用香精的主要成分(1)鉴别百里香酚和苏合香醇可采用的试剂为
;
(2)苏合香醇能发生的有机反应类型有
;(填序号)
A.加成反应
B.消去反应
C.加聚反应
D.缩聚反应
(3)写出符合下列条件的风信子醛的同分异构体的结构简式
;(任写一种)
a.含有苯环,苯环上有两个支链
b.与新制氢氧化铜悬浊液共热无砖红色沉淀
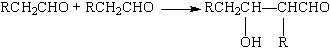 (4)已知醛在一定条件下可以两分子加成:
(4)已知醛在一定条件下可以两分子加成:
由枯茗醛合成兔耳草醛的路线如下:

①写出有机物A、B的结构简式 、 。 ②写出有机物C→兔耳草醛的化学方程式 。
28.有机物A的结构简式为:
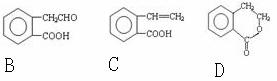
它可通过不同化学反应分别制得B、C和D三种物质。
(1)B中的含氧官能团名称是 、 。 (2)A→B的反应类型是 ;A-D中互为同分异构体的是 。 (3)由A生成C的化学方程式是 。 (4)C在一定条件下发生加聚反应的化学方程式是 。
27. 印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L、FeCl2 3.0mol/L、FeCl3 1.0mol/L、HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
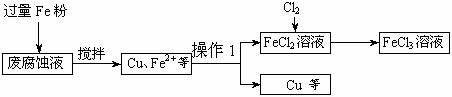
回答下列问题:
 (1)操作1的名称是
,上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
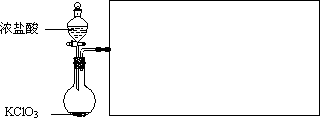
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为
。
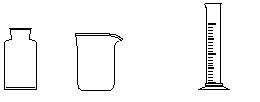
(3)右图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是:
。
(5)按上述流程操作,需称取Fe粉的质量应不少于
g(精确到0.1g),需通入Cl2的物质的量不少于
mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
(1)操作1的名称是
,上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为
。
(3)右图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
(4)实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是:
。
(5)按上述流程操作,需称取Fe粉的质量应不少于
g(精确到0.1g),需通入Cl2的物质的量不少于
mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
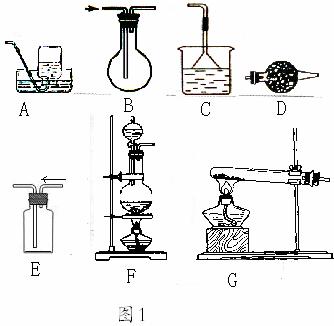
26. 某课外化学兴趣小组在实验室制备氨气,并进行有关氨气的性质探究。 (1)该小组同学加热生石灰与氯化铵的混合物制取干燥的氨气。 ①应该选用的仪器及装置有(填字母) 。
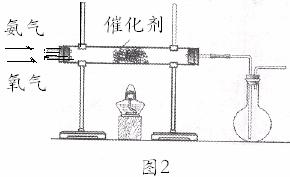 ②生石灰与氯化铵反应生成氨气的化学方程式为
。
(2)该小组同学设计如右下图2所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为
。该反应所用的催化剂一般
②生石灰与氯化铵反应生成氨气的化学方程式为
。
(2)该小组同学设计如右下图2所示装置探究氨气的还原性。
①氨催化氧化的化学方程式为
。该反应所用的催化剂一般
选用 (填写化合物名称) 。 ②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式可能为 。 (3)该小组同学以氨气和二氧化碳为原料拟制备碳酸氢铵。 ①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。选择合适的方案并说明原因。 同学方案比较合理,因为 。 ②检验产物中有NH4+的方法为 。
25. 硫酸是重要的化工原料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)现将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,反应2SO2(g)+O2(g)  2SO3(g)达到平衡状态。
①从平衡角度分析采用过量O2的目的是
;判断该反应达到平衡状态的标志是_____________。(填字母)
2SO3(g)达到平衡状态。
①从平衡角度分析采用过量O2的目的是
;判断该反应达到平衡状态的标志是_____________。(填字母)
a.SO2和SO3 浓度相等 b.SO2百分含量保持不变
 c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
②该反应的平衡常数表达式为:K=___________。
③已知:K(300℃)>K(450℃),该反应是________热反应。若反应温度升高,SO2的转化率 (填“增大”、“减小”或“不变”)。
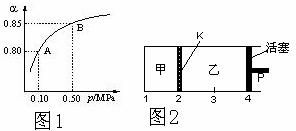
 (2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲 乙。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”,下同)。
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲
乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲 乙。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com