
题目列表(包括答案和解析)
23.(9分)已知2X2(g)+Y2(g)

 2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 , 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
2Z(g) ΔH=-akJ·mol-1(a>0),在一个容积固定的容器中加入2mol X2和1mol Y2 , 在500℃时充分反应达平衡后Z的浓度为W mol·L-1,放出热量b kJ。
⑴ 此反应平衡常数表达式为_________________;若将温度降低到300℃,则反应平衡常数将___________(填增大、减少或不变)。
⑵ 若原来容器中只加入2mol Z,500℃充分反应达平衡后,吸收热量c kJ,则Z浓度_______Wmol·L-1(填“>”、“<”或“=”),a、b、c之间满足关系___________(用代数式表示)。
⑶ 能说明反应已达平衡状态的是___________________。
A. 浓度c(Z)=2c(Y2) B. 容器内压强保持不变
C. v逆(X2)=2v正(Y2) D. 容器内的密度保持不变
⑷ 若将上述容器改为恒压容器(反应器开始体积相同),相同温度下起始加入2mol X2和1mol Y2达到平衡后,Y2的转化率将_____(填“变大”、“变小”或“不变”) 。
22.(6分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B、C、D、E是非金属单质,且在常温常压下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;
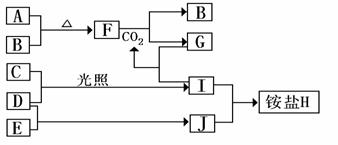
请完成下列填空:
(1)H的化学式 、F的电子式 。
(2)F和CO2的化学方程式 。
写出G溶液中逐滴加入等物质的量的I溶液反应的离子方程式 。
(3)A与B 在加热条件下反应的主要现象是 ;检验H 中阳离子的方法是 。
21.(10分)下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,
回答下列问题:
 族 族周期 |
IA |
|
|
|
|
|
|
0 |
|
1 |
① |
ⅡA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
|
⑨ |
⑩ |
|
⑴ ⑤⑥⑨⑩的离子半径由大到小的顺序为______________(用离子符号表示)。
⑵比较④⑨的氢化物沸点高低顺序并说明理由____________________________。
⑶ lg单质①在常温下完全燃烧生成气态产物放出Q kJ的热量,请写出其表示燃烧
的热化学方程式_________________________________________。
⑷由表中两种元素组成的电子数与⑨相同的化合物的化学式为________________。
⑸由⑦⑩两种元素组成的一种化合物,其水溶液呈_________性(填“酸”、“碱”或“中”),其原因_____________________(用离子方程式表达)。
⑹由④⑤两种元素组成的一种化合物加入到硫酸亚铁溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式__________________________________。
20.取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如右图所示。则原H2SO4物质的量浓度是
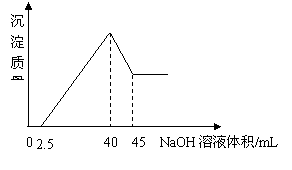
A.1mol/L B.2mol/L C.3mol/L D.4mol/L
19.金属铜的提炼多从黄铜矿开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为: 2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
A.O2只做氧化剂
B.CuFeS2既是氧化剂又是还原剂
C.SO2既是氧化产物又是还原产物
D.若有1mol O2参加反应,则反应中有4mol电子转移
18.下列说法或表示方法正确的是
A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石) △H = +1.90 kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、② pH=4的稀盐酸中由水电离出的c (H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO-)
17.下列离子方程式书写正确的是
A.CaCO3与醋酸反应:CaCO3 +2H+=Ca2+ +CO2↑+H2O
B.向碳酸氢钠溶液中加入氢氧化钠溶液:HCO3-+ OH- = CO2↑ + H2O
C.KI溶液与H2SO4酸化的H2O2溶液混合:2 I- + H2O2 + 2 H+ =2 H2O + I2
D.碳酸氢钠溶液中加入过量石灰水:
2HCO3- + Ca2+ + 2OH- = CaCO3↓+ CO32-+ 2H2O
16.某酸性溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法正确的是
A.溶液中离子浓度可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.该溶液不能由等物质的量浓度、等体积的盐酸和氨水混合而成
C.可由pH=3的盐酸与pH=11的氨水等体积混合而成
D.再通入适量氨气,溶液中离子浓度可能为:c(NH4+)>c(C1-)>c(H+)>c(OH-)
15.若NA表示阿伏加德罗常数,下列说法正确的是:
A.1mol H2O2含有极性共价键为NA,含有非极性键为2NA
B.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
C.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
14.烷烃
 是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有
是由某单烯烃与H2加成后的产物,考虑烯烃的顺反异构,则这种单烯烃的结构可能有
A.4种 B.5种 C.7种 D.9种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com