
题目列表(包括答案和解析)
3.向100 mL FeBr2溶液中通入标准状况下氯气3.36 L,测得所得溶液中c (Cl-)= c ( Br-) ,则原FeBr2溶液物质的量浓度为( )
A.0.75 mol/L B. 1.5 mol/L C.2 mol/L D.3 mol/L
2.下列各分子中所有原子都满足最外层8电子结构的是( )
A.BeCl2 B.PCl3 C.PCl5 D.H2O
1.下列说法错误的是( )
A.同温同压下体积相同的物质,其物质的量未必相同
B.14C原子中有8个中子
C.用渗析法分离Fe(OH)3胶体和FeCl3溶液的混合物
D.放热反应的生成物总能量高于反应物总能量
23.(14分)上海世博会英国馆--种子圣殿,由六万多根透明的亚克力[其分子式是(C5H8O2)。]杆构建而成。某同学从提供的原料库中选择一种原料X,设计合成高分子亚克力的路线如图-8所示:
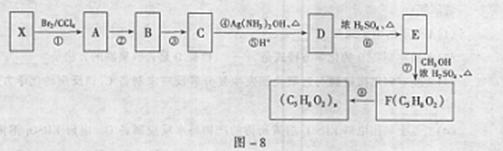
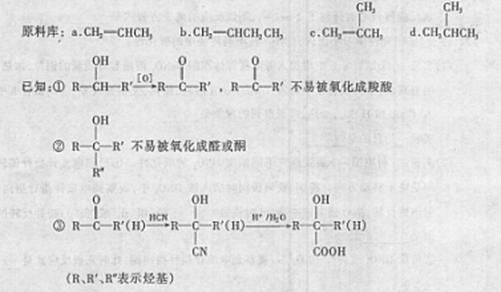
请回答:
(1)原料X是 (选填序号字母)。
(2)②的反应条件是 ;⑧的反应类型是 ;D中官能团的名称 。
(3)⑦的化学方程式是 。
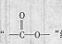
(4)C有多种同分异构体,其中分子中含有 结构的共有 种。
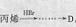
(5)某同学以丙烯为原料设计了合成中间体D的路线: ,得到D的同
时也得到了另一种有机副产物M,请你预测M可能的结构简式是 。


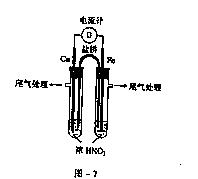
22.(9分)某研究性学习小组探究NO3在不同环境中的氧化性。
(1)实验一:①试管a、b中均加入等浓度等体积的NaNO3溶液和等质量的铜片,加热,无明显现象;②向试管a中加入VmL NaOH溶液,加热,无明显现象;③向试管b中加入VmL稀H2SO4,加热,可观察到的现象是 。
实验一的目的是 。
(2)实验二:利用图-7装置探究不同浓度HNO3的氧化性。①已知电流计指针偏转方向足电子移动方向。将铜、铁两极同时插入浓HNO3中,观察到电流计指针指向铜,但迅速反转,指针偏向铁一端,此时铁做 极(填“正”或“负”);指针反转的原因是 。
②将浓HNO3改为稀HNO3后,观察到电流计指针指向铜,此时正极反应式是
。
21.(12分)A、B、C、D均为氢化物,其分子中所含原子数依次为2、3、4、4。A、C的分子中原子个数比均为1:1,且电子总数均为18;B与C的元素种类相同;B、D的分子均含10个电子,B与D反应得到一种一元弱碱。
请回答:
(1)A分子的电子式是 。
(2)实验室制备D的化学方程式是 ;检验D是否收集满的方法是 。
(3)实验室利用稀硫酸与过氧化钡发生复分解反应来制备c,该反应的化学方程式是
。
(4)工业上利用电解KHSO4溶液所得的产物与水反应制备C。电解KHSO4溶液时,阳极反应式是2HSO-4-2e-=S2SO2-8+2H+,阴极反应式是 ;已知1molS2O2-8与水反应得到C时转移了2 mole-,则该反应的离子方程式是 。
20.(11分)为探索工业废料的再利用,某化学兴趣小组设计了如图-5实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
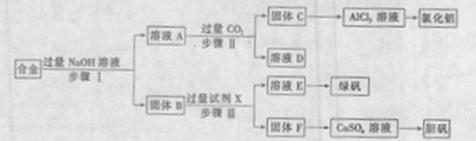
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液A中的离子主要有 ;试剂X是 。
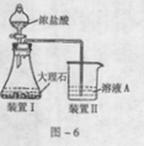
(3)进行步骤II时,该小组用图-6所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免固体C减少,根据图-6所示,改进的措施是 。
(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是 。
19.(12分)氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
|
温度/°C |
200 |
300 |
400 |
500 |
600 |
|
氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13.8 |
请回答:
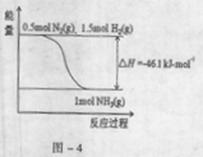
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是 。
(2)根据-4,合成氨的热化学方程式是 。
(3)在一定温度下,将2molN2和6molH2通入到体积为1L的密闭容器中,发生反应
 N2+3H2 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是
。
N2+3H2 2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
;该温度下的平衡常数K= (用分数表示);俗使K增大,可以采取的措施是
。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是 (选填序号字母)
a.及时分离出NH3 b.升高温度
c.增大压强 d.使用催化剂
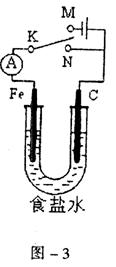
18.如图-3所示,将铁棒和石墨棒擦入l L l mol·L-1食盐水中。
下列说法正确的是 ( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是
4OH--4e-=2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现
铁棒上镀铜
D.若电键K与M连接,当两极共产生28 L(标准状况)
气体时,生成了1 mol NaOH
第Ⅱ卷(非选择题 共58分)
本卷共5小题,共58分。
17.某同学在三个容积相同的密闭容器中,研究三种不同
条件下化学反应2x(g) Y(g)+w(g)的进行情况。
Y(g)+w(g)的进行情况。
其中实验I、Ⅱ控温在Ti,实验Ⅲ控温在T,它们的
起始浓度均是c(X)=1.0 mol·L-1,c(Y)=c(w)=0,测
得反应物X的浓度随时间的变化如图-2所示。下列
说法不正确的是 ( )
A.与实验I相比,实验Ⅱ可能使用了催化剂
B.与实验I相比,实验Ⅲ若只改变温度,则温度
T1<T2,该反应是吸热反应
C.在实验I、Ⅱ、Ⅲ中,达到平衡状态时x的体积
百分含量相同
D.若起始浓度c(X)= 0.8 mol·L-1,c(Y)=c(w)=0,
 其余条件与实验l相同,则平衡浓度c(X)= 0.4 mol·L-1
其余条件与实验l相同,则平衡浓度c(X)= 0.4 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com