
题目列表(包括答案和解析)
24.(14分)某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:
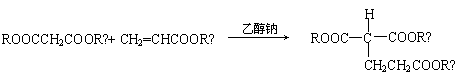 ① E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3︰1。
① E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3︰1。
②
(R、R′、R″代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是 。
(2)D→E反应的化学方程式是 。
(3)A→B反应所需的试剂是 。
(4)G→H反应的化学方程式是 。
(5)已知1 mol E 与2 mol J 反应生成1 mol M,则M的结构简式是 。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有 种,其中任意1种的结构简式是 。
(7)J 可合成高分子化合物,该高分子化合物结构简式是 。
北京市西城区2010 - 2011学年度第一学期期末试卷
23.(8分)有关FeSO4的转化关系如下图所示(无关物质已略去)。
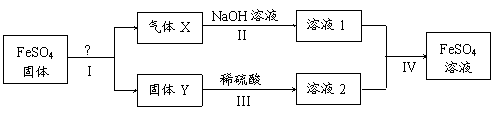
已知:① X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,
产生白色沉淀。
② Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应I的反应类型属于(填序号) 。
a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应I得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol/L NaOH溶液完全吸收,则反应IV中生成FeSO4的离子方程式是 。
22.(8分)兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。
|
序号 |
实验操作 |
实验现象 |
|
I |
稀硫酸中加入铜片 |
无明显变化 |
|
II |
硝酸钠溶液中加入铜片 |
无明显变化 |
|
III |
稀硫酸中加入硝酸钠溶液 |
无明显变化 |
|
再加入铜片 |
有无色气泡;溶液变蓝 |
① 实验I、II的目的是 。
② 实验III中反应的本质是(用离子方程式表示) 。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
① Cu作 极。 ② 总反应的离子方程式是 。
21.(12分)以食盐为原料进行生产并综合利用的某些过程如下图所示。

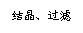
(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号)
。
离子,加入下列沉淀剂的顺序是(填序号)
。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是 。
(3)电解饱和食盐水反应的离子方程式是 。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是 。
(5)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
② 常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。
则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是 。
③ 工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知碳酸的酸性强于次氯酸)。
20.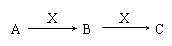 (6分)现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。
(6分)现有3种化合物A、B、C均含短周期元素R,其转化关系如下图所示。
(1)若A由第三周期2种元素组成。常温下,0.1 mol/L X溶液的pH=13,则R在周
期表中的位置是 ,X中阴离子的电子式是 ,B转化为
C的离子方程式是 。
(2) 若常温下A、B、C、X均为气态物质,1 mol A中含有共价键的数目约为1.806×1024, X为单质,A与X反应生成B的化学方程式是 ;在一定条件下,
A可与C反应消除C对大气的污染,该反应的化学方程式是 。
19.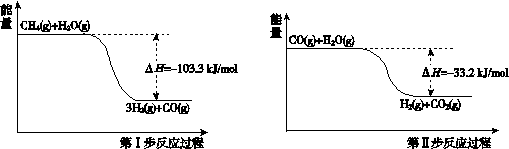 (6分)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(6分)氢气是一种清洁能源。用甲烷制取氢气的两步反应的能量变化如下图所示:
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始
浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反
应的平衡常数为 ,CO的平衡转化率为 。
18.(4分)常温下,有浓度均为0.1 mol/L的4种溶液:①盐酸;②硫酸;③醋酸;
④氢氧化钡。(注:忽略溶液混合时体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号) 。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是 。
17.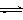 将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH<0。
将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) 2C(g) ΔH<0。
4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
第Ⅱ卷(非选择题 共58分)
16.已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量 B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目 D.溶液中溶质的质量分数
15.下列离子方程式书写正确的是
A.铝片放入NaOH溶液中:2Al + 2OH-= 2AlO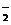 + H2↑
+ H2↑
B.碳酸钙溶于醋酸中:CaCO3 + 2H+= Ca2+ + CO2↑+ H2O
C.氯气通入NaOH稀溶液中:Cl2 + 2OH-= Cl-+ ClO-+ H2O
D.Ba(OH)2溶液与过量NaHSO4溶液混合:H+ + SO + Ba2+ + OH-= BaSO4↓+ H2O
+ Ba2+ + OH-= BaSO4↓+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com