
题目列表(包括答案和解析)
17.(8分)工业生产硝酸铵的流程图如下:
请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________________(任写一条)
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92 kJ·mol-1。请回答:
2NH3(g),ΔH=-92 kJ·mol-1。请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是_________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式。_______________________________________________________________________
该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(增大、减小、无影响),其原因是_____________________________________。
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为_______________。
16、铝及铝合金经过阳极氧化,铝表面能生成几十微米的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理。他们的实验步骤如下:
a.铝片的预处理,取出一定大小的铝片,依次用苯、酒精擦洗铝片的表面
 b.用水冲洗经有机物擦洗的铝片,浸入60-70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
b.用水冲洗经有机物擦洗的铝片,浸入60-70℃的2mol/L的NaOH溶液中,约l min后,取出用水冲洗干净,再用钼酸铵溶液处理以抑制电解生成的氧化铝被硫酸溶解。
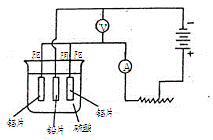
c.阳极氧化。以铅为阴极,铝片为阳极,以硫酸溶液为电解液,按照下图连接电解装置,电解40min后取出铝片,用水冲洗,放在水蒸汽中封闭处理20-30min,即可得到更加致密的氧化膜。
试回答下列问题
①用苯和酒精擦拭铝片的目的: ,氢氧化钠溶液处理铝片的目的是: 。
②下列有关说法正确的是 (填序号)。
A.电解时电流从电源正极→导线→铝极,铅极→导线→电源负极
B.在电解过程中,H+向阳极移动,SO42-向阴极移动
C.电解过程中阳极周围的pH明显增大
D.电解的总方程式可表示为:2Al +6H+  2Al3+
+3H2↑
2Al3+
+3H2↑
③阴极的电极反应式为: 。
15.(1)化学实验必须注意安全,下列做法存在安全隐患的是 (选填序号)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拨开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300℃的温度计代替量程为200℃的温度计,测反应液的温度
14、向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24 mol B.0.21mol C.0.16 mol D.0.14 mol
13.下列溶液中各微粒的浓度关系不正确的是
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)==c(H+)
B.1L0.lmol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
12.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2。A的核磁共振氢谱有4个峰且面积之比为1∶2∶2∶3,A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中,正确的是
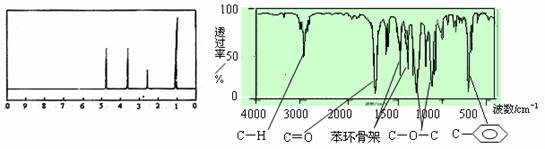
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与4 mol H2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
11.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A. 25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
B.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移约0.2×6.02×1023个电子
C.1 mol羟基(-OH)所含的电子数约为10×6.02×1023
D.标准状况下,测得一定量的铜与硝酸反应后生成22.4 L的混合气体 ,则被还原的硝酸的分子数应大于6.02×1023
10.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法不正确的是
A.电池总反应为:Mg+H2O2=Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向负极移动
一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选
两个且都正确的得满分,但只要选错一个该小题就为0分(本大题包括6小题,每题4分,
共24分)。
9. 下列反应方程式书写正确的是
A. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O = AgOH↓+ NH4+
B. 钢铁发生吸氧腐蚀的正极反应:4OH--4e- = 2H2O + O 2↑
C. 20mL0.1mol/LAlCl3溶液中加入70mL0.1 mol·L-1NaOH溶液:2Al3++7OH- = Al(OH)3↓+AlO2-+2H2O
D. 向Ba(OH)2稀溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3•H2O+H2O
8.将氨水滴加到盛有AgC1的试管中,AgC1逐渐溶解,对上述过程,下列叙述或解释正确( )
A.所得溶液中c(Ag+)×c(C1-)<KSP(AgC1)B.所得溶液中形成了更难电离的物质
C.上述实验说明C1与NH4+间有很强的结合力 D.上述过程中NH3·H2O的电离程度增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com