
题目列表(包括答案和解析)
20.(10分)A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,Y是生活中用量最大的金属,该反应的条件是高温。相关物质间的关系如下图所示。
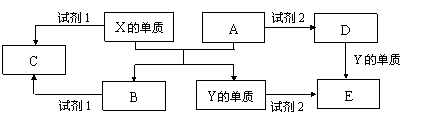
⑴X的单质与A反应的化学方程式是 。
⑵若试剂1是NaOH溶液,
①X的单质与试剂1反应的离子方程式是 。
②0.1摩X的单质参加反应转移的电子数 。
⑶若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 。
②某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
19.(16分)填写下列空格
(1)Na2CO3俗称是:_________,稳定性Na2CO3______NaHCO3(填“强于”、“弱于”)。
(2)除去SO2中混有少量的HCl,需加的试剂为_________ ,
有关反应的化学方程式___________________ 。
(3)现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘片;⑦冰 七种物质。
a.熔化时不需要破坏化学键的是__________(填序号,下同)。
b.属于离子化合物的是__________,物质中只有离子键的物质有________。
c.② ④ ⑤ ⑥ ⑦熔点由高到低的顺序为____________。
18、有镁铝的混合物10.2g,将其完全溶于500mL4mol/L的盐酸中,再向其中
滴加NaOH溶液,若要使沉淀质量达到最大值,则需要加入2mol/L的NaOH
溶液的体积为:
A、1000mL B、500mL C、100mL D、1500mL
第Ⅱ卷(共46分)
17、氯化硼的熔点为107℃。在氯化硼分子中,氯硼键之间的夹角为1200,它可
水解,水解产物之一能在空气中产生白雾。下列关于氯化硼的说法正确的是
A、氯化硼是原子晶体 B、氯化硼分子是极性分子
C、熔化时,氯化硼能导电 D、水解方程式:BCl3+3H2O=H3BO3+3HCl
16、PH3在常温下是无色有大蒜气味的气体,它的分子呈三角锥形,以下关于PH3
的叙述中正确的是:
A、PH3是非极性分子 B、PH3中有孤电子对
C、PH3是一种强氧化剂 D、PH3分子中P-H键是非极性键
15.对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g)减小压强时,对反应产生的影响是:
2Z(g)减小压强时,对反应产生的影响是:
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
14.在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.2 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(H2)=0.3 mol·L-1·min-1
13、下列各组热化学方程式中,化学反应的△H前者大于后者的是
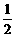
①C(s)+O2(g) = CO2(g);△H1 C(s)+O2(g) = CO(g);△H2
 ②S(s)+O2(g) = SO2(g);△H3
S(g)+O2(g) = SO2(g);△H4
②S(s)+O2(g) = SO2(g);△H3
S(g)+O2(g) = SO2(g);△H4
③H2(g)+O2(g) = H2O(l);△H5 2H2(g)+O2(g) = 2H2O(l);△H6
④CaCO3(s) = CaO(s)+CO2(g);△H7 CaO(s)+H2O(l) = Ca(OH)2(s);△H8
A.① B.④ C.②③④ D.①②③
12.  和
和 是氧元素的两种核素,
是氧元素的两种核素,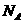 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A. 与
与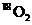 互为同分异构体
互为同分异构体
B.  与
与 核外电子排布方式不同
核外电子排布方式不同
C.通过化学变化可以实现 与
与 间的相互转化
间的相互转化
D.标准状况下,1.12L 和1.12L
和1.12L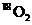 均含有0.1
均含有0.1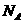 个氧原子
个氧原子
11. 下列说法正确的是
A.第三周期非金属元素含氧酸的酸性从左到右依次增强(除Ar外)
B.形成离子键的阴阳离子间只存在静电吸引力
C.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
D.元素周期律是元素原子核内质子排布周期性变化的结果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com