
题目列表(包括答案和解析)
8.将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是 ( )
A.浅紫色 B.黄色 C.红色 D.无色
7.下列推断正确的是 ( )
A.等质量的NaHCO3和Na2CO3固体中,分别加入一定量盐酸,NaHCO3产生的气体多
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液最终呈红色
6.下列各组物质在适宜的条件下反应,其中氧化剂与还原剂物质的量之比为1:1的是( )
A.F2 + H2O B.Li + O2(条件点燃)
C.CO2+Mg D.NO2+H2O
5.下列分子中所标注的原子不采取sp3杂化的是 ( )
A.手性碳原子 B.NO2-中的氮原子
C.ClO3-中的氯原子 D.NH2-中的氮原子
4.下列关于物质结构与性质的叙述中,正确的是 ( )
A.氢键的存在一定会使物质的熔点升高
B.因为蛋白质分子与胶体粒子大小相近,故蛋白质溶液具有胶体的某些性质
C.丁达尔现象是胶体粒子对光线反射形成的,可以用于区分胶体和悬浊液
D.可以用电子气理论解释大多数金属容易发生锈蚀的性质
3.下列物质中,含元素种类由多到少排列正确的是:①液氯;②氨水;③超重水、重水和普通水的混合物;④明矾;⑤水玻璃;⑥天然蛋白质。 ( )
A.⑥④⑤②③① B.④⑥⑤②③①
C.⑥④②⑤③① D.⑥④⑤②①③
2.化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是 ( )
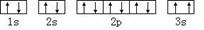 A.基态Mg原子的核外电子排布图:
A.基态Mg原子的核外电子排布图:
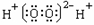 B.过氧化氢电子式:
B.过氧化氢电子式:
C.As原子的简化电子排布式为:[Ar]4s24p3
D.原子核内有10个中子的氧原子:

1.下列说法中,不正确的是 ( )
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都符合绿色化学的思想
B.同位素示踪法是研究化学反应历程的手段之一
C.焰色反应主要是利用了原子光谱中原子吸收光谱
D.比能量是衡量电池优劣的主要标准之一
22.(10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 制水煤气的化学反应方程式为:_____________________________________。
⑵ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g); ΔH=a kJ·mol-1
CH3OH(g); ΔH=a kJ·mol-1
② 2CH3OH(g)
 CH3OCH3(g) + H2O(g);ΔH=b kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=b kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g); ΔH=c kJ·mol-1
CO2(g) + H2(g); ΔH=c kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g)
+ CO2 (g)的ΔH=
___________ ;(与abc的函数关系)。若
△H<0,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
CH3OCH3(g)
+ CO2 (g)的ΔH=
___________ ;(与abc的函数关系)。若
△H<0,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是_______(填字母代号)。
a.高温 b.高压 c.减少CO2的浓度
d.分离出二甲醚 e.增加CO的浓度 f.加入催化剂
⑶ 已知反应②2CH3OH(g)  CH3OCH3(g) + H2O(g) 。某温度下,在密闭容器中加入CH3OH ,反应到平衡时测得各组分的浓度如下:
CH3OCH3(g) + H2O(g) 。某温度下,在密闭容器中加入CH3OH ,反应到平衡时测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.64 |
0.5 |
0.5 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经8 min反应达到平衡,该时间内反应速率v(CH3OH) = _____。
21、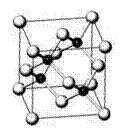 (10分)砷化镓(GaAs)属于第三代半导体,它能直接
(10分)砷化镓(GaAs)属于第三代半导体,它能直接
将电能转变为光能,砷化镓灯泡寿命是普通灯
泡的100倍。已知砷化镓的晶胞结构如右图。
又知砷为33号元素 镓为31号元素。
试回答下列问题:
⑴砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃ 进行,反应的方程式为: 。AsH3空间形状
为 (CH3)3Ga中镓原子杂化方式: 。
⑵Ga的核外电子排布式为: 。
⑶AsH3沸点比NH3低,其原因是: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com