
题目列表(包括答案和解析)
2.下列有关比较中,大小顺序排列错误的是 ( )
A.沸点:NH2>PH3>AsH3
B.熔点:石英>食盐>干冰
C.结合质子的能力:CO43>CHCOO->SO2-3
D.热稳定性:HF>HCl>HBr>HI
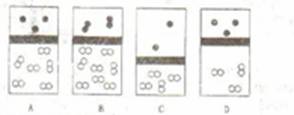
1.下列示意图中,白球代表氢原子,黑球代表氧原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计),其中能表示等质量的氢气与氧气的是( )
26.(14分)常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式__________________________。
(2)若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液中离子浓度由大到小顺序为
已知Ksp(BaA) = 1.8×10-10,向该混合溶液中加入10mL 1 mol·L-1 BaCl2溶液,混合后溶液中的Ba2+浓度为___________ mol·L-1。
(3)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液②0.01mol·L-1的NaHA溶液③0.02mol·L-1的HCl与0.04mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为_______ ;pH由大到小的顺序为_________________ 。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液C(H+)/C(OH-)=104,V1与V2的大小关系为___________(填“大于、等于、小于”或“均有可能”)。
25.(13分)下图是元素周期表的一部分,其中所列字母分别代表某一元素
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
j |
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
d |
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
|
f |
|
|
g |
h |
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|
k |
|
|
|
|
(1)写出元素k基态原子的核外电子排布式________________________。
(2)e、f单质及ef形成的合金的硬度由大到小的顺序为_______________________(用具体名称回答)
(3)用来组成酸、碱、盐三类物质至少需要的元素有___________________(用表中列出元素的化学式填写)
(4)短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第
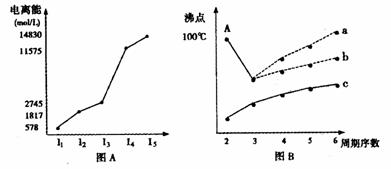 族。
族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线:折线a和折线b,你认为正确的是 。
24.(10分)惰性电极电解NaCl溶液或CuSO4溶液都得到三种产物A、B、C,各物质之间的转化关系如下图所示(图中参与反应和生成的水都已略去)。已知甲是短周期元素的单质,它是日常生活中常用的包装材料。
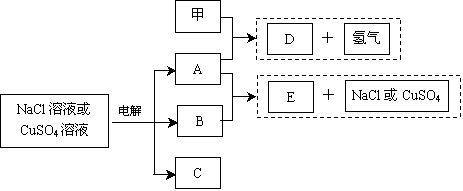
回答下列问题:
(1)若电解的是NaCl溶液:
①甲与A反应的化学方程式是 ;
②A与B反应的离子方程式是 ;
③若电解100mL0.1mol·L-1NaCl溶液,阴、阳两极各产生112mL气体(标准状况),则所得溶液的pH为 (忽略反应前后溶液的体积变化及气体溶于水的影响)
(2)若电解的是CuSO4溶液:
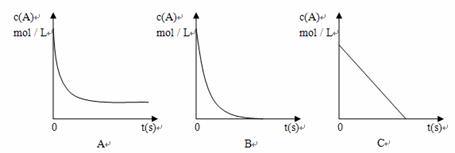
①E的化学式是 ;电解时阳极的电极反应式是 ;
②加热时,A的浓溶液可与B发生反应,A的浓度随时间变化的图像正确是 。
23.(13分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
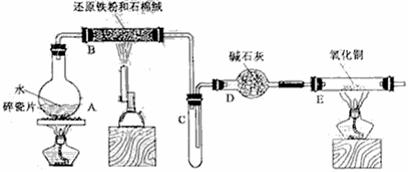
(1)装置B中发生反应的化学方程式是 ;
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用试剂为 ,检验Fe2+所用试剂为 。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:

①步骤一中通入足量Cl2发生反应的离子方程式为 。
②步骤二从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行):
蒸发、浓缩 → 冷却、结晶 → 过滤、洗涤、干燥
在蒸发皿中进行蒸发浓缩操作时,当_________________________时,应停止加热。此过程应保持盐酸过量的原因________________________________________(用离子方程式表示)。
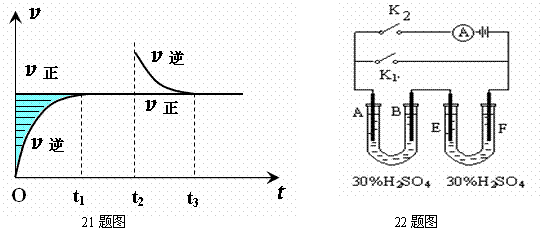
22.铅蓄电池的工作原理为Pb + PbO2 + 4H+ + 2SO42- == 2PbSO4 + 2H2O。研读上图,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极。先闭合K1足够长时间后断开K1。下列有关说法中不正确的是:(本题装置图在上页) ( )
A.1mol Pb和1mol PbO2具有的总能量大于2mol PbSO4具有的总能量
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.两U型管均可单独作为原电池使用,正极分别为A和F
D.若再单独闭合K2,电极A、B的质量会逐渐增加,电极E、F的质量会逐渐减小
第Ⅱ卷(本卷共4小题,共50分)
21.某恒温密闭容器发生可逆反应Z(?)+W(?)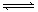 X(g)+Y(?) ΔH
,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
X(g)+Y(?) ΔH
,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
A.Z和W在该条件下一定不为气态
B.t1-t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不相等
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1-t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
20.己知:NH3•H2O (aq)与H2SO4 (aq)反应生成1mol正盐的△H= -24.2kJ/moL;强酸、强碱的稀溶液反应的中和热的△H= -57.3kJ/mol。则NH3•H2O在水溶液中电离的△H等于 ( )
A.-69.4 kJ/mol B.-45.2kJ/mol
C.+69.4 kJ/mol D.+45.2 kJ/mol
19.下列离子方程式书写不正确的是 ( )
A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,
2Al3+ + 7OH- = Al(OH)3↓+ AlO2- + 2H2O
B.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,
2Fe2+ + 4Br- +3Cl2 = 2 Fe3+ + 2Br2 + 6Cl-
C.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时
Cu2++2HS-= CuS↓+2H2S↑
D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,
3 Fe +2NO3- +8H+ = 3 Fe2+ +2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com