
题目列表(包括答案和解析)
18.在25 mL0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如下图所示,有关粒子浓度关系不正确的是 ( )
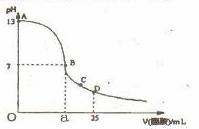
A.在A、B间任一点,溶液中一定都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点:a>12.5
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
[答案]A
[解析]当在NaOH溶液中滴入少量醋酸时,NaOH远远过量,因此有c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错。当酸碱恰好完全反应时生成CH3COONa,水解显碱性,而在B点时,溶液显中性,因此反应中醋酸必过量,因此有a>12.5。C点时溶液中的溶质是CH3COOH和CH3COONa,溶液显酸性,说明醋酸的电离程度大于醋酸钠的水解程度,因此C正确。根据物料守恒可知选项D正确。
[考点]电解质溶液--离子浓度大小比较
17.如图是某研究小组采用电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是 ( )
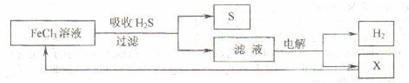
A.吸收H2S的离子方程式为:Fe3++H2S = Fe2++S↓+2H+
B.电解过程中的阳极反应主要为:2Cl--2e- = Cl2↑
C.该工艺流程体现绿色化学思想
D.实验室可用点燃充分燃烧的方法消除H2S污染
[答案]C
[解析]选项A不符合电荷守恒,正确的离子方程式为2Fe3++H2S = 2Fe2++S↓+2H+,所得滤液中含有Fe2+、H+和Cl-,由于还原性Fe2+>Cl-(或根据图示循环),电解时阳极反应式为Fe2+-e-=Fe3+,故B错。由于H2S充分燃烧的化学方程式为2H2S+3O2 =2SO2+2H2O,生成的SO2也是一种有毒气体,故D也错。
[考点]电化学,非金属元素及其化合物
16.等质量的三份锌a、b和c,分别加入足量的稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COONa。下列各图中表示其产生H2总体积(V)与时间(t)的关系,其中正确的是 ( )
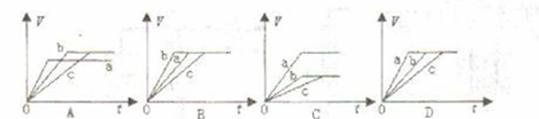
[答案]A
[解析]从化学反应速率角度分析:a中加入CuSO4溶液后,形成Zn-Cu-稀硫酸原电池,加快了反应速率,c中加入了CH3COONa后,由于降低了溶液中的c(H+),减慢了反应速率。从生成H2的角度分析,b和c中生成H2的量相同,但均比a多,综上分析A正确。
[考点]
15.在一定温度下,将等量的气体分别通入起始体积相同的密闭容器I(恒容)和II(恒压)中,使其发生反应,t0时容器I中达到化学平衡,X、Y、Z的物质的量的变化如图所示),则下列有关推断正确的是 ( )
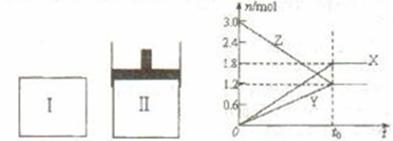
A.该反应的化学方程式为:3X+2Y 3Z
3Z
B.若两容器中均达到平衡后,两容器的体积V(I)<V(II),则容器II达到平衡所用时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.达平衡后,若对容器II升高温度时其体积增大,说明Z发生的反应为吸热反应
[答案]C
[解析]由物质的量--时间曲线图可知该反应中Z是反应物,而X和Y是生成物,故正确的化学方程式应为3Z3X+2Y,A错。若平衡后V(I)<V(II),则P(I)>P(II),压强越大反应速率越快,由此可知容器II达到平衡所用时间大于t0,B错。选项C可依据等效平衡判断是正确的。由于生成物的状态未知,且温度升高气体均会膨胀,因此通过题给条件无法判断反应的热效应。
[考点]化学反应速率与化学平衡
14.可用右侧示意图像表示的是 ( )
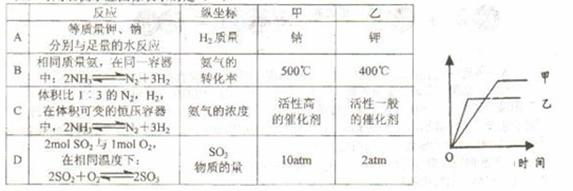
[答案]A
[解析]由于合成氨反应是放热反应,因此氨的分解反应是吸热反应,温度越高,反应速率越快,氨的转化率越大,但图像不符合选项B中的速率变化。由于催化剂的使用不会改变化学平衡状态,即选项C中两条件下c(NH3)应该相等,C错。由于合成SO3的反应是一个气体体积增大的反应,增大压强,反应速率加快,SO2的转化率越大,n(SO2)越小,故D错(和选项A一样,图像也不符合选项D中的速率变化要求)。
[考点]化学反应速率与化学平衡、金属元素及其化合物
13.下列各选项中所述的两个量,前者一定大于后者的是 ( )
A.pH=10的NaOH和Na2CO3溶液中,水的电离程度
B.物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH4+的物质的量浓度
C.将pH=3的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
D.相同温度下,10 mL0.1 mol·L-1的醋酸与100 mL0.01mol·L-1的醋酸中的H+物质的量
[答案]B
[解析]水中加入碱NaOH后抑制了水的电离,水中加入可水解的盐Na2CO3后促进了水的电离,故选项A中前者小于后者。由于NH4+水解显酸性,CO32-水解显碱性,即CO32-的存在会促进NH4+的水解,故B正确。由于醋酸中存在电离平衡,在加水稀释过程中还会电离出H+,因此选项C中加水量前者小于后者。对于弱电解质溶液,越稀越容易电离,因此选项D中同样是前者小于后者。
[考点]电解质溶液--电离与水解
12.下列混合溶液中,各离子浓度的大小顺序正确的是 ( )
A.10 mL0.1mol·L-1氨水与10 mL0.1mol·L-1盐酸混合:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.10 mL0.1mol·L-1 NH4Cl与5 mL0.2mol·L-1NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL0.1mol·L-1醋酸与5 mL0.2mol·L-1 NaOH混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL0.5mol·L-1CH3COONa溶液与6mL0.1mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
[答案]B
[解析]选项A中两者恰好完全反应生成NH4Cl,水解显酸性,应有c(OH-)<c(H+),故A错。选项C中两者恰好完全反应生成CH3COONa,水解显碱性,应有c(Na+)>c(CH3COO-),故C错。选项D中两者反应盐酸过量,溶液显酸性,应有c(OH-)<c(H+),故D错。
[考点]电解质溶液--离子浓度大小比较
11.关于下列各装置图的叙述中,错误的是 ( )
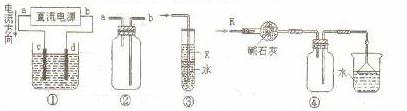
A.装置①用来电解饱和食盐水,C电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③中X为苯,可用于吸收氨气或氯气
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
[答案]C
[解析]根据电流方向可知a为电源的正极,电解时c作阳极,氯离子在阳极放电生成Cl2,故A正确。由于未指明从a管进气还是从b管进气,故装置②既可以收集密度比空气大的气体,也可能收集密度比空气小的气体,B正确。由于装置③中导管直接插入水中,故苯未起到任何作用,若用来吸收氨气仍引起倒吸,C错。选项D显然是正确的。
[考点]化学实验
10.下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) DH=-a kJ·mol-1
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
[答案]D
[解析]将NH3液化分离,使得化学平衡正向移动,可提高N2、H2的转化率,但由于生成物NH3的浓度减小,故正逆反应速率均减慢,A错。中和热定义中强调酸和碱反应生成1mol水的热效应,而已知条件给出的反应中生成了2mol水且有BaSO4沉淀生成,故B错。根据电解原理,Cl2在阳极室生成,使用离子交换膜可防止阳极室产生的Cl2进入阴极室,C错。
[考点]化学反应原理--反应热、化学反应速率与化学平衡、电化学
9.下列各种情况下,溶液中可能大量存在的离子组是 ( )
A.澄清透明的溶液中:I-、Cl-、ClO-、Na+
B.由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:K+、Ba2+、OH-、NO3-
C.使pH试纸呈红色的溶液中:K+、Fe2+、NO3- 、MnO4-
D.含有大量Fe2+的溶液中:K+、Na+、SO32 -、SO42 -
[答案]B
[解析]选项A中I-和ClO-发生氧化还原反应而不能大量共存。选项C中附加条件说明溶液显酸性,故Fe2+与NO3- 、Fe2+与MnO4-均因发生氧化还原反应而不能大量共存。选项D中SO32 -和Fe2+发生双水解反应(或部分氧化还原反应)而不能大量共存。
[考点]化学用语及常用计量--离子共存问题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com