
题目列表(包括答案和解析)
7.设NA表示阿伏加德罗常数的值,下列叙述中正确的是 A.常温常压下,8.8gCO2和N2O的混合物中所含有的原子数为0.6NA
B.Cu和足量的稀硝酸反应产生4.48L气体时,转移的电子数为0.6NA
C.标准状况下,3.36L丁烷中含有的非极性键数为0.6NA
D.在1L 0.2mol·L-1的硫酸铁溶液中含有的铁离子数为0.6NA
6. 在第36个“世界地球日”,我国国土资源部确定的主题为“善待地球-科学发展-构建和谐”。你认为下列行为中不符合这一主题的是
A. 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等石化燃料
B. 控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
C. 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D .实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
12.(1)氧(1分) CD(1分)
(2)Na2O2+SO2 Na2SO4,(2分)
(3)HSO3-+H+ SO2↑+H2O;(2分)
(4)HS-+OH- S2-+H2O(2分)
(5)2:3(2分)
(6)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g);△H=-641.5kJ·mol-1(3分)
12.(13分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有
原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;
D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、
B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点 B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素的单质与氢气化合的难易
(2)写出C、D两元素形成的原子个数比为1:1的化合物与E、C两元素形成的原子个数比为1:2的化合物反应的化学方程式: 。
(3)A、C 、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
.
(4)A与C和E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)B元素的气态氢化物和其一种常见氧化物(双原子分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为 。
(6)在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A44和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
11.A、B、C、D、E、F、G为七种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
|
微粒代码 |
A |
B |
C |
D |
E |
F |
G |
|
原子核数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
|
电荷数(单位电荷) |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
其中B的离子半径大于E的离子半径;D是由极性键构成的4个原子的极性分子,C与F可形成两个共价型G分子。
⑴A微粒的质子结构示意图是 。
⑵B与E的最高价氧化物对应水化物的碱性强弱为 > (用化学式表示)。
⑶D溶于水的电离方程式为 。
⑷G微粒所构成的晶体类型属于 。
⑸C微粒是 ,F微粒是 。(用化学式表示)
22.(物质结构与性质,12分)
氢是新型清洁能源,但难储运。研究发现,合金可用来储藏氢气。镧(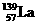 ) 和镍(
) 和镍(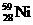 ) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
) 的一种合金就是储氢材料。该合金的晶胞如右图,镍原子除一个在中心外,其他都在面上,镧原子在顶点上。储氢时氢原子存在于金属原子之间的空隙中。
(1)一定条件下,该贮氢材料能快速、可逆地存储和释放氢气,若每个晶胞可吸收 3 个 H2, 这一过程用化学方程式表示为: 。
(2)下列关于该贮氢材料及氢气的说法中,正确的是 ( 填序号 )
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
C.该材料贮氢时采用常温高压比采用常温常压更好
D.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
E.己知镧和镍的第一电离能分别为 5.58eV、7.64eV, 可见气态镧原子比气态镍原子更容易变成+1 价的气态阳离子
(3)某研究性学习小组查阅的有关镍及其化合物的性质资料如下:
 ①写出 Ni3+ 的核外电子排布式:
①写出 Ni3+ 的核外电子排布式:
②写出将NiO(OH) 溶于浓盐酸的离子方程式:
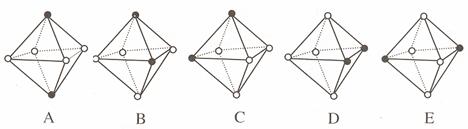
(4)Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 得到新的配合物,则以下物质中互为同分异构体的是 。 ( 填字母编号,任填一组 )( 图中黑点为NH3,圆圈为CO,Ni略去)
21.(8分)为研究水滑石的组成、结构和性质,某校研究性学习小组取得了二种牌号的水滑石样品拟进行探究,请你参与探究并回答相关问题。
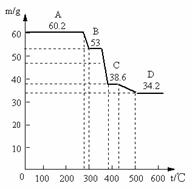 (1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
(1)甲同学取天然水滑石样品进行恒重分析,已知天然水滑石的化学式可表示为:6MgO·Al2O3·CO2·12H2O,取0.1mol水滑石进行加热时,温度与剩余固体质量的关系如下图,平行线上的数字表示残留固体的质量。
当温度在0-280℃质量不变,是什么原因: 。
A→B减少的物质及其物质的量为: ;
C→D减少的物质及其物质的量为: ;
D处化学组成为: 。
(2)乙组取的CA(美国化学文摘)登记号为12304-65-3 的合成水滑石样品,现只知其化学式为:MgaAlb(OH)C(CO3)d, a+b+c+d=25, a、b、c、d为正整数。取该水滑石样品0.1mol,用1mol/L盐酸使其完全溶解。
①消耗盐酸的体积至少为: L(用字母表示);
②若参加反应的盐酸的物质的量与生成CO2的物质的量之比为18∶1,则该水滑石的化学式为: 。
20.(12分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)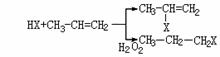 (X为卤素原子)
(X为卤素原子)
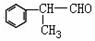 (2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为
的物质,该物质是一种香料。
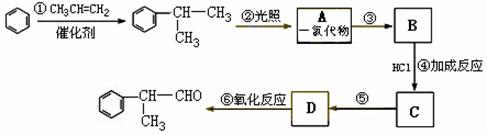
请根据上述路线,回答下列问题:
(1)A的结构简式可能为 和 。
(2)反应①、③、⑤的反应类型分别为
、 、 。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件)
。
(4)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
。
19.(10分)某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
 b.小火煮沸溶液1-2 min;
b.小火煮沸溶液1-2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式 ____________________、____________________________。
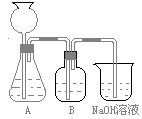
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密性________________________________________。
(3)装置B中盛放的试剂是______________,作用是_______________________________。
(4)在实验室通常制法中,装置A还可作为下列_____________气体的发生装置(填序号)。
 ①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4, ⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶 液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
18.(10分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个。甲、乙、丙是3种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己、庚七种物质之间的相互反应关系如图:
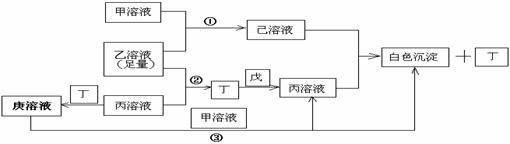
(1)画出C元素核外电子排布式____________,戊的电子式_____ ______。
(2)用有关化学用语解释:
乙溶液呈酸性的原因____________ __________;
丙溶液呈碱性的原因_________ ___________;
(3)写出有关反应①②③的离子方程式:
① ;
② ;
③ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com