
题目列表(包括答案和解析)
2.下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同
C.水玻璃和Na2SO3长期暴露在空气中变质
D.常温下铁分别加入浓硫酸和浓硝酸中均无明显现象
1.下列说法正确的是
A.酸雨形成的主要原因是汽车尾气的任意排放
B.填埋法是垃圾处理的最佳方法
C.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好
D.淀粉、纤维素、蛋白质和油脂均属于天然高分子化合物
25.已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。②常温下将气体D通入水中发生反应,生成C和E;③工业上以A、空气和水为原料,通过催化氧化法制取E。请回答以下问题:
⑴ B分子中含有的化学键为 ;A的分子式为 ;
(2)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
24.将某一元酸HA与NaOH等体积混合,请根据题目
要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是 ( )
A测得0.Imol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.C( HA) +c( H+)= c(OH-)
③若HA(足量)+B2一
A一+HB-;H2B(少量)+2C- B2-+2HC:
HA+C- A-十HC
则相同pH的①NaA②Na2B③NaHB④NaC的四种溶液,各物质的物质的量浓度从大到小的顺序为 (填序号)。
(2)若c( HA)==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏低的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
23.对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的_______________。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为_______________。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因(用离子方程式表示)___________________________。
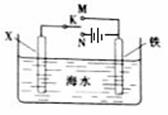 (2)利用如图装置,可以模拟铁的电化学防护。
(2)利用如图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应
置于______处。若X为锌,开关K置于M
处,该电化学防护法称为_______。
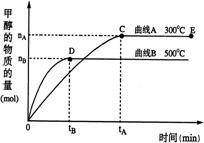
22.一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO): CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)合成甲醇反应中,其反应热△H 0(填“>”“<”“=”)
(2)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2 下列有关该体系的说法正确的是
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时n(H2)/n(CH3OH)增大
(3)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
21.常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:
(1)溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是 和 ;
(2)溶液中n(CH3COO-) + n(OH-) - n(H+) = _____________mol。
20.常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000
mol·L
NaOH溶液滴定 20.00mL0.1000
mol·L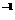
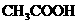 溶液所得滴定曲线如右图。下列说法正确的是 ( )
溶液所得滴定曲线如右图。下列说法正确的是 ( )
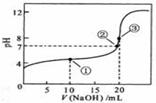
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:
c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
19.反应CO(g)+H2O(g)  CO2(g)+H2(g)
ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g)
ΔH=-41.2kJ·mol-1,在800℃时的化学平衡常数K=1.0。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
|
CO |
H2O |
CO2 |
H2 |
|
0.5 mol |
8.5 mol |
2.0 mol |
2.0 mol |
此时反应中正、逆反应速率的关系式是 ( )
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
18.有五瓶溶液分别是①10mL0.60mol/LNaOH水溶液 ②20mL0.50mol/L硫酸水溶液
③30mL0.40mol/LHCl溶液 ④40mL0.30mol/LHAc水溶液 ⑤50mL0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com