
题目列表(包括答案和解析)
9、将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生反应:2A(g)+B(g) 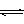 2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法:
2C(g),若经2 s后测得C的浓度为0.6 mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
其中正确的是 A.①③ B.①④ C.②③ D.③④
8、某同学用下列装置制备并检验Cl2的性质.下列说法正确的是 ( )
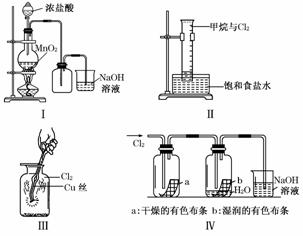
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结
果有Cl2生成
7、有关常温下pH均为3的醋酸和硫酸的说法正确的是 ( )
A.两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol/L
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO-)和硫酸中的c(SO)相等
D.分别加入足量锌片,两种溶液生成H2的体积相同
6、25℃时,水的电离达到平衡:H2O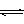 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
5、下列化学反应的离子方程式正确的是
A.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=[Al(OH)4]-
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
4、若NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.含有NA个氖原子的氖气在标准状况下的体积约为11.2L
B.2.3gNa被O2完全氧化时,失去电子数为0.1NA。
C.2Llmol·L-1的盐酸中所含氯化氢分子数约为2NA
D.标准状况下,5.6LCCl4含有的分子数为0.25NA
3、将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是 ( )Ⅰ
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
2、钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是 ( )
A.原电池的正极反应为:O2 + 2H2O + 4e-→4OH-
B.原电池的负极反应为:Fe→Fe3++3e-
C.钢铁设备上连接铜块可以防止腐蚀
D.钢铁与外加直流电源的正极相连可以防止腐蚀
1、为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法正确的是
A.NaClO溶液的消毒原理是使蛋白质变性
B.1molCl2与足量NaOH溶液反应转移2mol电子
C.NaClO溶液的漂白原理与Na2O2、SO2相同
D.“84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果
24、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: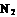 +3
+3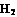
 2
2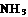 ,则在电化学合成氨的过程中,阴极反应式为
;
,则在电化学合成氨的过程中,阴极反应式为
;
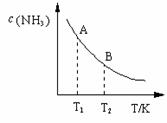 (3)在一定条件下,将l
mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
(3)在一定条件下,将l
mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为 ;
②右图中在状态A时,平衡常数 KA (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时, KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
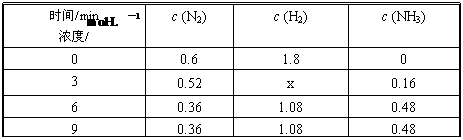

反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com