
题目列表(包括答案和解析)
19、(1)下列操作会导致实验结果偏高的是
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线。
B.在配制一定物质的量浓度溶液时,用 10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
E.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:a.铁架台(含铁圈、铁夹) b.锥形瓶c.滴定管 d.烧杯(若干) e.玻璃棒 f.胶头滴管 g.托盘天平(含砝码) h.滤纸 i.量筒 j.漏斗 k.温度计。
现有下列试剂:A.NaOH固体 B.碳酸钠溶液 C.氯化镁溶液 D.蒸馏水,试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是 。
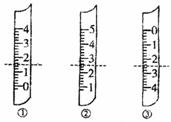 A.①是量简,读数为1.5mL
A.①是量简,读数为1.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
(2)配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器是
(3)除去 Mg(OH)2中混有的少量 Ca(OH)2,可以用的试剂是: (选填序号),操作方法是 、 洗涤。完成上述操作,上述仪器或用品用到的有 (从上述仪器或用品中选择,并填上相应序号)。
18、下列选项中正确的是
A. 1L0.5mol·L-1稀硫酸与1L1mol·L-1氢氧化钠溶液反应放出57.3kJ的热量:
H2SO4(aq) +2NaOH(aq) = Na2SO4(aq) +2H2O(1);△ H = -57.3 kJ· mol-1
B. 某酸的酸式盐NaHY水溶液显碱性,则H2Y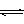 2H++Y2-
2H++Y2-
 C. 纯碱溶液显碱性的原因用离子方程式可表示为:CO32-+2H2O
C. 纯碱溶液显碱性的原因用离子方程式可表示为:CO32-+2H2O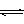 H2CO3+2OH-
H2CO3+2OH-
D.以惰性电极电解KCl溶液的离子方程式为:2Cl-+2H2O H2↑+2OH-+Cl2↑
第Ⅱ卷(46分)
17、下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=c(H+)+c(CH3COOH)
D.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+)
16、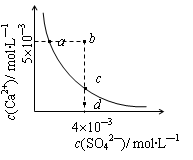 常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)
一定等于3´10-3 mol·L-1
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
15、金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备
高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-→Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
14、在下列溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO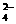 、Fe3+?
、Fe3+?
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO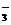 、Cl-
、Cl-
C.c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br-
D.能与铝反应放出氢气的溶液中:K+、NO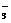 、Cl-、Cu2+
、Cl-、Cu2+
13、用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是 ( )
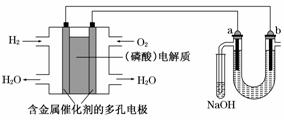
A.电池工作时,正极反应式为:O2+2H2O+4e-→4OH-
B.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
12、关于下列四个图像的说法中正确的是 ( )
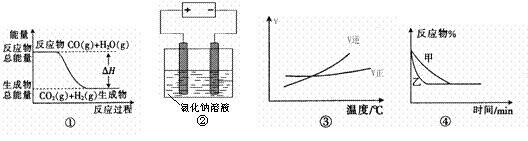

A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B.图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH小于0
2AB3(g)”的ΔH小于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
11、“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。已知
该电池的总反应为2H2+O2 =2H2O,负极反应为H2 + CO32-→CO2↑ + H2O + 2e-,则下列推断中,正确的是 A.电池工作时,CO32-向负极移动
B.电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C.正极的电极反应为:4OH-→O2↑+2H2O+2e-
D.通氧气的电极为阳极,发生氧化反应
10、实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)  I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
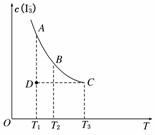 A.该反应的正反应是吸热反应
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率vA<vC
C.在反应进行到D点时,v正>v逆
D.A点与B点相比,B点的c(I2)大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com