
题目列表(包括答案和解析)
12.一定温度下,将4molPCl3和2molCl2充入容积不变的密闭容器中,在一定条件下反应:
PCl3+Cl2  PCl5 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和1molCl2 ,相同温度下达到平衡,PCl5的物质的量为
PCl5 ,各物质均为气态。达平衡后,PCl5为0.8mol。若此时再移走2molPCl3和1molCl2 ,相同温度下达到平衡,PCl5的物质的量为
A. 0.8mol B. 0.4mol C. 0.4mol < x < 0.8mol D.< 0.4mol
双项选择题(本题共2小题,每小题6分,共12分)
11.浓度05mol·L-1的 ①盐酸 ②醋酸 ③NH4Cl溶液 ④NaCl溶液,溶液中水电离的c(H+)由大到小的顺序是
A. ③④②① B. ①②④③ C. ①②③④ D. ③④①②
10.在一密闭的容器中,反应aA(g)  bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的55%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的55%,则
A.平衡向正反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数减少了 D.a > b
9.在一定温度下,在一个密闭容器中加入H2和I2蒸气各0.5摩,发生反应H2+I2  2HI,达到平衡时,生成HI 0.7摩,若其它条件不变,开始充入的H2为2摩,则达到平衡时生成的HI可能是下列中的
2HI,达到平衡时,生成HI 0.7摩,若其它条件不变,开始充入的H2为2摩,则达到平衡时生成的HI可能是下列中的
A.1.0摩 B .0.8摩 C.0.7摩 D.0.5摩
8.在四个不同的容器中,在不同的条件下进行合成氨反应。根据在相同时间内测定的结果判断,生成氨的速率最快的是( )
A.υ(H2)=0.1 mol·L-1·min-1 B.υ(N2)=0.2 mol·L-1·min-1
C.υ(NH3)=0.15 mol·L-1·min-1 D.υ(H2)=0.3 mol·L-1·min-1
7.对已达化学平衡的下列反应:2X(g)+Y(g) 2Z(g)减小压强时,对反应产生的影响是
2Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
24、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为: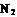 +3
+3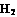
 2
2 ,则在电化学合成氨的过程中,阴极反应式为
;
,则在电化学合成氨的过程中,阴极反应式为
;
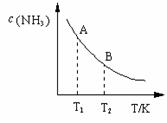 (3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:
①N2的转化率为 ;
②右图中在状态A时,平衡常数 KA (填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时, KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
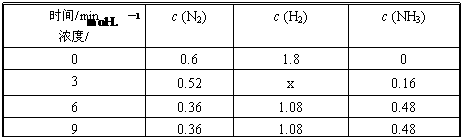

反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
23、Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是 。电池工作时,电子流向 (填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是 。若电解电路中通过2mol电子,MnO2的理论产量为 克。
21.()(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者 后者(填“<”、“>”或“=”).
(2)在25℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同) .
A.5 B.7 C.3-5之间 D.5-7之间
(3)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”,下同 )。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中c(Na+) c(CH3COO-)
(5)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
(6)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。(多选、错选不得分)
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质;
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;k.s.5.u
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
E.未用标准液润洗碱式滴定管。
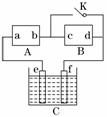 22、右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C
点显红色,请填空:
22、右图A为直流电源,B为渗透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B 上的 C
点显红色,请填空:
(1)电源A的a为 极。
(2)滤纸B上发生的总反应方程式为:
。
(3)欲在电镀槽中实现铁上镀铜,接通K点,使c、d两点短路,则电极e的电极材料为 ,f极上发生的反应为: 。
20、中学化学实验中,淡黄色的pH试纸常用于测定溶液的酸碱性.在25℃时,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡:
H2O+H2O H3O++OH- ΔH>0
H3O++OH- ΔH>0
现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是 (填字母).
A.向水中加入NaHSO4
B.向水中加入Na2CO3
C.加热水至100℃[其中c(H+)=1×10-6 mol/L]
D.在水中加入(NH4)2SO4
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显 色,溶液呈 性(填“酸”、“碱”或“中”);若用pH计测定,则pH 7(填“>”、“<”或“=”),溶液呈 _性(填“酸”、“碱”或“中”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com