
题目列表(包括答案和解析)
4、下列说法中,正确的是
A.离子化合物一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定不含非极性键
D.由于水分子之间存在氢键,所以水分子比较稳定
3、化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.电解MgCl2饱和溶液,可制得金属镁
C.Al2O3的熔点很高,可用于制作耐高温材料
D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
2、化学科学需要借助化学专用语言来描述,下列化学用语的书写正确的是
A.
硫原子的原子结构示意图:
B.HClO结构式:H-Cl-O
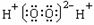 C.过氧化氢电子式:
C.过氧化氢电子式:
D.原子核内有10个中子的氧原子:
1、下列各组气体中均能造成大气污染的是 A、CO2、O2 B、N2、NO2 C、H2S、SO2 D、Cl2、N2
30.(16分)有机物E和可用作塑料增塑剂或涂料中的溶剂F,它们的分子量相等,可用以下方法合成:
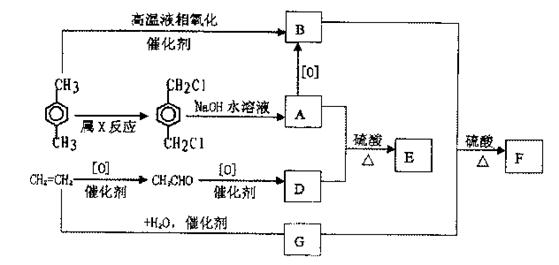
请写出:
(1)有机物的名称:A 、B
(2)化学方程式:A+D→E
B+G→F
(3)X反应的类型及条件:类型 ,条件 ;
(4)E和F的相互关系属 (多选扣分)
①同系物 ②同分异构 ③同一物质 ④同一类物质

29.(16分)
(1)下面a-e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
①若用上述仪器配制500mL 2mol.L-I的NaCl溶液,还缺少的玻璃仪器是烧杯
。
②若用上述仪器测定中和热,则缺少的玻璃仪器为烧杯 。
(2)某混合物粉末可能含有Al.Fe.Fe0.Al2O3,某研究小组在实验室积极探究其组成。
①研究小组首先排除了含有单质Al的可能性,加入的试剂是--(填序号)
A.硫酸 B.盐酸 C.氨水 D.氢氧化钠溶液
证明不含单质铝的现象是 。
②该混合物的组成基本确定为Fe、FeO、Al2O2。请以上述粉末为样品,验证其组成。限选实验仪器与试剂:烧杯.试管.玻璃棒.胶头滴管.药匙.过滤器;20%KSCN、3mol/LNaOH、3mol/L盐酸、3% H2O2、3mol/LCuSO4、蒸馏水。
根据你设计的实验方案,在答题卡上按下表的格式写出空白部分的实验操作.预期现象和结论。
|
实验操作 |
预期现象和结论 |
|
步骤1:取少量粉末于烧杯中,加入足量3mol/LNaOH溶液,充分搅拌,过滤,冼涤。 |
粉末减少,说明粉末可能含有Al203 |
|
步骤2:取少量步骤1的滤液于试管中,逐滴滴加3mol/L盐酸至过量。 |
, 说明粉末中含有Al2O3。 |
|
步骤3:将步骤1的滤渣转移到烧杯B中,加入足量3mol/L CuSO4,充分搅拌,过滤,洗涤。 |
有红色固体生成,说明粉末中含有__ __。 |
|
步骤4:
|
|
28.(16分)
(1)已知某溶液中只存在OH-、H+、CH3COO-、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Na+)c(CH3COO-)>c (OH->c (H+)
②c(Na+)> c>CH3COO-)>c(H+>c(OH-)
③c(CH3COO->c(Na+)>c(H+)>c(OH)
④c(Na+)>c(OH-)>c (CH3COO-)> c(H+)
若溶液中只溶解了一种容质,则该溶质是 ,上述四种离子浓度的大小顺序为 。(填编号)。
若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好旱中性,则混合前两溶液的物质的量浓度大小关系为c(NaOH) c (CH33COOH)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系是c(H+) c(OH-)
(2)美国科学家成功开发便携式固体氧化物燃料电池,它以丙烷气体为燃料,每填充一次燃料,大约可连续24小时输出50W的电力。一极通入空气,另一极通入丙烷气体,电解质是固态氧化物,在熔融状态下能传导O2-。
则在熔融电解质中,O2-由 极移向 极;电路中每流过10 mol电子,标准状况下约有 L丙烷被完全氧化; 通丙烷的电极为电池 极,发生的电极反应为
27.(12分)如图,各物质有下列转化关系:

请同答以下问题:
①若C是可用作自来水消毒的气体, D.E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 。
②若B为常见金属或非金属单质,E是酸酐,且为易挥发的晶体,则A是 。
D转化为E的一定条件是 。 ③若C是水,B是有机化合物,且是同系物中相对分子质量最小的物质,E能使紫色石蕊试液变红色。则A是 。
④某溶液中可能含有I-.NH4+.Na+.SO2-3,向该溶液中通入①中的少量c气体,溶液仍呈无色,则该溶液肯定小含 ,肯定含 。
13.下列离子方程式书写正确的足 ( )
A.在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO32-+4H+
B.过量二氧化碳通入偏铝酸钠溶液中:CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
C.等物质的量的亚硫酸氢铵与氢氧化钠溶液混合NH4++HSO3-+2OH-=SO2-3+NH3 ↑+2H2O
D.碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO-3 +Ca2++2OH-=CaCO3 ↓+2H2O+MgCO3↓
12.2006年4月,齐齐哈尔第二制药有限公司生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭,药品安全问题引起人们的关注。“亮菌甲素”为利胆解痉药,适用于急性胆囊炎.慢性胆囊炎急性发作及慢性浅表性胃炎等。主要成分是 ( )
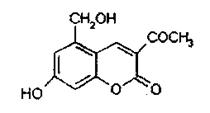 A.“亮菌甲素”的分子式为C12H10O5
A.“亮菌甲素”的分子式为C12H10O5
B.每摩尔该物质最多能和6mol H2发生加成反应
C.每摩尔该物质最多能和4mol NaOH发生反应 .
D.分子内所有的C原子处于同一平面
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com