
题目列表(包括答案和解析)
22.(5分)常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L HCl溶液和20. 00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示。
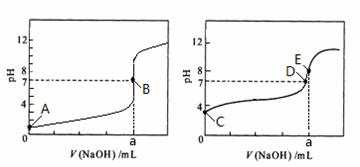
图1 图2
(1)由A、C点判断,滴定HCl溶液的曲线是 (填“图1”或“图2”);
(2)a = mL;
(3)c(Na+) = c(CH3COO-)的点是 ;
(4)E点对应离子浓度由大到小的顺序为 。
21、(10分)近年来北京市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。
(1)汽车内燃机工作时引起反应:N2(g)+O2(g)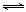 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则T ℃时该反应的平衡常数K=
。(计算结果保留小数点后两位数字)
(2)一定量的NO发生分解的过程中,NO的转化率随时间变化的曲线如右图所示。
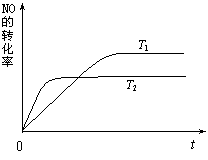
①反应 2NO(g) 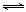 N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
N2(g)+O2(g)为(填“吸热”或“放热”)
反应。
|
 N2(g)+O2(g) 已达到平衡的是(填序号) 。
N2(g)+O2(g) 已达到平衡的是(填序号) 。
a.容器内的压强不发生变化 b.NO、N2、O2的浓度保持不变
c.NO分解的速率和NO生成的速率相等 d.单位时间内分解4 mol NO,同时生成2 mol N2
(3)①当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2= 。
②使用催化剂可以将汽车尾气的主要有害成分一氧化碳(CO)和氮氧化物(NOx)转化为无毒气体,
该反应的化学方程式为 。
20.(12分)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
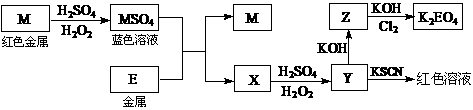
⑴写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
⑵某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
⑶写出Cl2将Z氧化为K2EO4的化学方程式: 。
 ⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为:
⑷由E制备的E(C2H5)2的结构如右图,其中氢原子的化学环境完全相同。但早期人们却错误地认为它的结构为: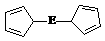 。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
。核磁共振法能够区分这两种结构。在核磁共振氢谱中,正确的结构有 种峰,错误的结构有 种峰。
19、(13分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C
两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A
位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是 。
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲: c(H+)丙 = ;丙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)0.1 mol D单质和0.2 mol E单质组成的混合物投入到足量的A2C中,产生气体的体积
(标准状况)是 。
(5)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 极(填“正”
或“负”),在碱性条件下其电极反应是 。
18、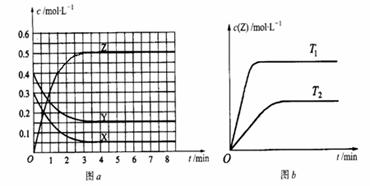 温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示。其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示。下列叙述正确的是
A.该反应的正反应是放热反应
B.T0时,该反应的平衡常数为1/3
C.图a中反应达到平衡时,Y的转化率为37.5%
D.反应时各物质的反应速率关系为:2 v (X) = 2 v (Y) = v (Z)

Ⅱ卷 非选择题(共58分)
17、水热法制备纳米颗粒Y(化合物)的反应为3Fe2+ + 2S2O32-+
O2 + aOH-== Y+S4O62-+2H2O,下列说法中,不正确的是
A.a=4 B.Y的化学式为Fe2O3
C.S2O32-是还原剂 D.每有1 mol O2参加反应,转移的电子总数为4 mol
16、25 ℃ 时,下列各溶液中关系的叙述中,正确的是
A.pH=1的盐酸与pH=1硫酸溶液中c(H+)之比为1∶2
B.pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,
则c(Na+) + c(H+)=c(OH-) + c(CH3COO-)
C.0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中
c(OH-) = 0.1 mol/L,则BA(盐)溶液pH<7
D.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度小于AgI
15、 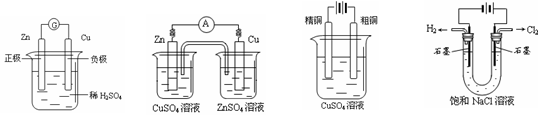 下图有关电化学的示意图正确的是
下图有关电化学的示意图正确的是
A. B. C. D.
14、几种短周期元素部分性质的数据见下表:
|
元素性质 |
元素编号 |
|
① ② ③ ④ ⑤ ⑥ ⑦ |
|
|
原子半径 |
0.74 1.60 1.52 1.10 0.99 1.86 0.75 |
|
最高正化合价 |
无
+2 +1 +5 +7 +1 +5 |
|
最低负化合价 |
-2 无 无 -3 -1 无 -3 |
下列说法正确的是
A.③、⑥号元素都是金属元素
B.⑤的单质(M)与水反应的化学方程式为:2M + 2H2O= 2MOH + H2↑
C.⑥是该周期元素中原子半径最小的元素
D.①、⑥号元素只能形成一种白色化合物
13、下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将SO2通入酸性KMnO4溶液中 |
证明SO2具有氧化性 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失 |
证明此溶液是Na2SiO3溶液 |
|
D |
分别向2支试管中加入相同体积但不同浓度的H2O2溶液,再向其中1支加入少量MnO2 |
研究催化剂对H2O2分解速率的影响 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com